题目内容
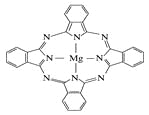
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如右图:
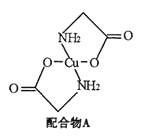
(1)Cu元素基态原子的外围电子排布图为 。
(2)配合物A中碳原子的轨道杂化类型为 。
(3)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为 。
键的数目为 。
(4)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体且为负一价阴离子: (写化学式)。
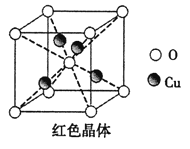
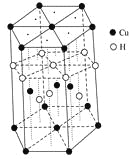
(5)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是 。
(6)配合物A中元素C、H、N、O组成CH4和NO在400~500℃和Pt做催化剂下转化成无毒害物质,利用该反应可以控制机动车尾气排放。该反应方程式为
___________ ________________ 。
【答案】(1)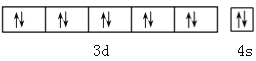
(2)sp2sp3
(3)8×6.02×1023或8NA
(4)SCN-或N3-或OCN- 等
(5)Cu2O
(6)![]()
【解析】试题分析:(1)Cu为29号元素,根据构造原理知铜元素基态原子的价电子排布式为3d104s1,外围电子排布图为 。
。
(2)配合物A中亚甲基中碳原子形成4个![]() 键,没有孤对电子,轨道杂化类型为sp3,羰基中碳原子形成3个
键,没有孤对电子,轨道杂化类型为sp3,羰基中碳原子形成3个![]() 键,没有孤对电子,杂化轨道类型为sp2。
键,没有孤对电子,杂化轨道类型为sp2。
(3)两个成键原子间有且仅有1个![]() 键,根据氨基乙酸钠的结构判断1mol氨基乙酸钠(H2N-CH2-COONa)含有
键,根据氨基乙酸钠的结构判断1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为8×6.02×1023或8NA。
键的数目为8×6.02×1023或8NA。
(4)原子总数和价电子总数相同的两种微粒互为等电子体。与二氧化碳的一种等电子体且为负一价阴离子有SCN-或N3-或OCN-。
(5)根据红色晶体的晶胞结构利用切割法分析1个晶胞中含O的数目:1+8×1/8=2,含Cu的数目:4,则该化合物的化学式是Cu2O。
(6)根据题意知CH4和NO在400~500℃和Pt做催化剂下转化成二氧化碳和氮气,利用化合价升降法配平,该反应方程式为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
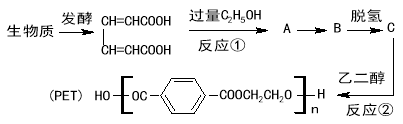
小学生10分钟应用题系列答案【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 、 、 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。
(4)称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00 mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数 。