题目内容
6.某反应中,A、B浓度随时间的变化如图所示,则表示正确的是( )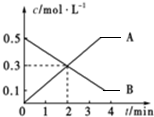
| A. | 前2 min内平均反应速率v(B)=0.3 mol•L-1•min-1 | |
| B. | 当A、B浓度不再变化时,此时反应速率为零 | |
| C. | 该反应的化学方程式为2A?3B | |
| D. | 前2 min内平均反应速率v(A)=0.15 mol•L-1•min-1 |
分析 A、根据v=$\frac{△c}{△t}$计算以B表示的平均反应速率;
B、当A、B浓度不再变化时,此时正逆反应速率相等,但不为零;
C、随反应进行反应物的物质的量减小,生成物的物质的量增大,反应结束反应物的物质的量为定值,反应为可逆反应,根据物质的量之比等于化学计量数之比,书写方程式;
D、根据v=$\frac{△c}{△t}$计算以A表示的平均反应速率.
解答 解:A、由图可知2min内B的物质的量浓度变化量为0.2mol/L,所以2min内以B表示的平均反应速率v(B)=$\frac{0.2mol/L}{2min}$=0.1mol/(L•min),故A错误;
B、当A、B浓度不再变化时,此时正逆反应速率相等,但不为零,故B错误;
C、由图可知随反应进行B的物质的量浓度变小,A的物质的量浓度变大,所以B为反应物,A为生成物,反应结束各物质的物质的量不变,所以反应为可逆反应,A、B的化学计量数之比为0.5:0.4=5:4,所以反应方程式为5A?4B,故C错误;
D、由图可知2min内A的物质的量浓度变化量为0.3mol/L,所以2min内以A表示的平均反应速率v(A)=$\frac{0.3mol/L}{2min}$=0.15mol/(L•min,故D正确;
故选D.
点评 考查反应速率、方程式书写、化学平衡计算等,难度不大,关键是读懂图象运用所学知识解决问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.有关Al与NaOH溶液反应的说法中,正确的是( )
| A. | Al是还原剂,NaOH及H2O均是氧化剂 | |
| B. | 还原产物是H2,且由H2O还原所得的H2与NaOH还原所得的H2物质的量的比为2:1 | |
| C. | 反应中1mol Al失去4mol电子 | |
| D. | 此反应中,只有水是氧化剂,NaOH既不是氧化剂也不是还原剂 |
11.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| A | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶、过滤 |
| B | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| C | 苯(硝基苯) | / | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
18.甲烷和乙烯是两种重要的有机物,区分它们的正确方法是( )
| A. | 观察两者的颜色 | B. | 观察两者的状态 | ||
| C. | 通入溴的四氯化碳溶液 | D. | 通入高锰酸钾酸性溶液 |
15.下列说法正确的是( )
| A. | 棉花、羊毛及合成纤维完全燃烧都只生成二氧化碳和水 | |
| B. | 淀粉、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 | |
| C. | 蛋白质遇饱和硫酸铵溶液产生的沉淀能重新溶于水 | |
| D. | 苯和乙烯都能使溴水褪色,均与溴发生加成反应 |
16.下列说法正确的是( )
| A. | 油脂有油和脂肪之分,但都属于酯 | |
| B. | 糖类、油脂、蛋白质都能发生水解反应 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物 | |
| D. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成 |
 根据如图原电池的装置图回答下列问题:
根据如图原电池的装置图回答下列问题: