题目内容
16.有关Al与NaOH溶液反应的说法中,正确的是( )| A. | Al是还原剂,NaOH及H2O均是氧化剂 | |
| B. | 还原产物是H2,且由H2O还原所得的H2与NaOH还原所得的H2物质的量的比为2:1 | |
| C. | 反应中1mol Al失去4mol电子 | |
| D. | 此反应中,只有水是氧化剂,NaOH既不是氧化剂也不是还原剂 |
分析 铝和氢氧化钠溶液的反应为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可理解为2Al+6H2O=2Al(OH)3+3H2↑、2Al(OH)3+2NaOH=2NaAlO2+4H2O,只有2Al+6H2O=2Al(OH)3+3H2↑中Al元素的化合价升高,水中H元素的化合价降低,以此来解答.
解答 解:A.Al为还原剂,只有水为氧化剂,故A错误;
B.还原产物是H2,只由H2O还原得到H2,故B错误;
C.该反应Al元素的化合价由0价升高到+3价,所以1molAl失去3mol电子,故C错误;
D.此反应中,Al元素的化合价升高,只有水中H元素的化合价降低,则只有水是氧化剂,NaOH既不是氧化剂也不是还原剂,故D正确;
故选D.
点评 本题考查铝的化学性质及氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
6.下列溶液与50mL 0.2mol/L的MgCl2溶液中的Cl-的物质的量浓度相等的是( )
| A. | 150mL 0.4mol/L的HCl | B. | 250mL 0.2mol/L的AlCl3 | ||
| C. | 250mL 0.3mol/L的BaCl2 | D. | 100mL 0.2mol/L的NaCl |
7.下列物质中,既属于有机物又属于酸的是( )
| A. | CO2 | B. | CH3COOH | C. | C2H5OH | D. | Fe |
4.几种短周期元素的原子半径及主要化合价见下表:
根据表中信息,判断以下说法正确的是( )
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.089 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2、+4、+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:X2+>T2- | |
| C. | 元素最高价氧化物对应的水化物的碱性:R>X | |
| D. | 相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z |
1.某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲灭火,却被实验老师及时制止,原因是CO2可以支持镁燃烧,发生反应:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,下列关于该反应的判断正确的是( )
| A. | Mg的化合价由0升高到+2,所以MgO是还原产物 | |
| B. | 由此反应可以判断氧化性CO2>MgO,还原性Mg>C | |
| C. | CO2作氧化剂,表现出氧化性,发生氧化反应 | |
| D. | Mg原子失去的电子数目等于氧原子得到的电子数目 |
6.某反应中,A、B浓度随时间的变化如图所示,则表示正确的是( )
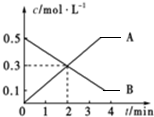

| A. | 前2 min内平均反应速率v(B)=0.3 mol•L-1•min-1 | |
| B. | 当A、B浓度不再变化时,此时反应速率为零 | |
| C. | 该反应的化学方程式为2A?3B | |
| D. | 前2 min内平均反应速率v(A)=0.15 mol•L-1•min-1 |
7.某同学设计如下元素周期表,以下说法正确的是( )

| A. | X、Y、Z元素分别为N、P、O | |
| B. | 白格中都是主族元素,灰格中都是副族元素 | |
| C. | 原子半径:Z>X>Y | |
| D. | X、Y、Z的气态氢化物中最稳定的是:Y的氢化物 |
 ;
; 业生产中M与水反应的产物之一可用于漂泊和杀菌,写出M与水初步反应的化学方程式NCl3+3H2O═NH3+3HClO.
业生产中M与水反应的产物之一可用于漂泊和杀菌,写出M与水初步反应的化学方程式NCl3+3H2O═NH3+3HClO.