题目内容
【题目】在下图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法错误的是
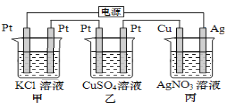
A.当丙中Cu电极质量增加21.6g,甲中共产生4.48 L气体
B.电解过程中丙中溶液pH无变化
C.向甲中加入适量的盐酸,可使溶液恢复到电解前的状态
D.乙中左侧电极反应式:Cu2++2e-=Cu
【答案】AC
【解析】
通电片刻即发现乙装置左侧电极表面出现红色固体,则此红色固体为Cu,即乙装置左侧为阴极,右侧为阳极;甲装置中,左铡电极为阴极,右侧电极为阳极;丙装置中,左侧电极为阴极,右侧电极为阳极。
A. 当丙中Cu电极质量增加21.6g,电路中转移电子0.2mol,甲中产生Cl2 0.1mol,H2 0.1mol,标况下体积为4.48L,因为题中没有强调“标准状况”,所以气体体积不一定是4.48L,A错误;
B. 在丙装置中,阳极Ag-e-=Ag+,阴极Ag++e-=Ag,所以电解过程中丙溶液pH无变化,B正确;
C. 甲中阳极生成Cl2,阴极生成H2,相当于从溶液中逸出HCl气体,若向甲中加入适量的盐酸,则加入了水,溶液浓度减小,不能恢复到电解前的状态,C错误;
D. 乙中左侧铜离子放电,电极反应式:Cu2++2e-=Cu,D正确。
故选AC。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目