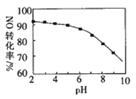
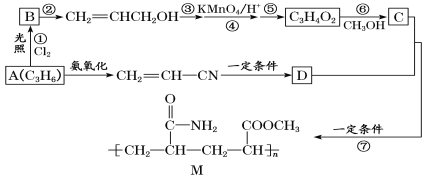
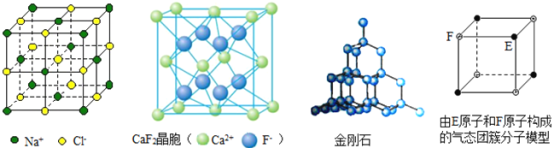
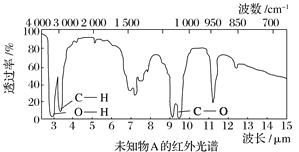
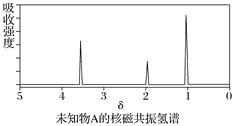
题目内容
【题目】锌-空气电池适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时,下列说法正确的是
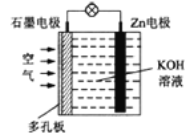
A. 电池工作时溶液中的OH-向石墨电极移动
B. Zn电极发生了氧化还原反应
C. 电子经过溶液移向石墨电极
D. 锌电极的电极反应式:Zn + 2OH--2e- = ZnO + H2O
【答案】D
【解析】
本题考查了原电池反应方程式及发生原理,注意电子流动方向,培养综合运用与读图能力。
根据图像可知,在氢氧化钾溶液中,锌与空气反应, 2Zn+O2=2ZnO,锌电极发生氧化反应,作为负极,石墨为正极。
A. 电池工作时,溶液中电子从锌电极通过导线向石墨电极流动,OH-向负极移动,向锌电极移动,A错误;
B.锌电极发生氧化反应,原电池整体发生氧化还原反应,B错误;
C.电子经过导线移向正极,溶液中移动的是离子,C错误;
D.石墨电极反应式O2+2H2O+4e-=4OH-,故锌电极的电极反应式:Zn + 2OH--2e- = ZnO + H2O,D正确。
答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】用氯化铁浸出一重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
步骤1:称取试样0.100g于250mL洗净的锥形瓶中。
步骤2:加入FeCl3溶液100mL,迅速塞上胶塞,用电磁搅拌器搅拌30min。
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中。
步骤4:将滤液稀释至500mL,再移取100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴。
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点。发生的反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
步骤6:重复测定两次,数据如下:
第一次 | 第二次 | 第三次 | |
消耗的K2Cr2O7标准溶液体积(mL) | 10.01 | 9.99 | 13.00 |
步骤7:数据处理。
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为___,迅速塞上胶塞的原因是___。
(2)步骤3中判断滤纸上残渣已洗净的方法是___。
(3)实验中需用到100mL浓度约为0.01mol·L-1K2Cr2O7标准溶液,配制时用到的玻璃仪器有___;称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是___(填“偏高”、“偏低”或“无影响”);滴定时,K2Cr2O7溶液应置于___(填仪器名称)中。
(4)利用上表数据,计算出该钛精粉试样中单质铁的质量分数为___(写出必要的计算过程)。
【题目】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层![]() 能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
(2)![]() 、
、![]() 均为短周期金属元素。依据下表数据,写出
均为短周期金属元素。依据下表数据,写出![]() 原子的核外电子排布式:______。
原子的核外电子排布式:______。
电离能/ |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |