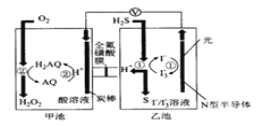
题目内容
【题目】氧化铜与硫酸反应得硫酸铜。
(1)胆矾晶体结晶水含量测定实验中,恒重操作完成的标准是______________。
(2)利用如图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量如图下方的表格所示。

装置 | A(试管+粉末) | B | C |
反应前 | 50.0 g | 70.0 g | 540.0 g |
反应后 | 45.0 g | 74.5 g | 540.0 g |
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:_______________。
【答案】连续两次称量结果相差不超过0.001g 4CuSO4![]() 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
【解析】
(1)恒重操作完成的标准是前后两次质量标准相差小于0.001 g;
(2)A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃,得出反应产物有氧化铜和氧气,根据氧化还原反应中得失电子相等,得出还原产物二氧化硫和氧气的物质的量之比为2:1,根据质量守恒定律来来计算产物硫的氧化物和氧气的质量比,进而确定三氧化硫的化学计量数,再根据硫原子守恒配平方程式。
(1)胆矾晶体结晶水含量测定实验中,要不断的对物质进行加热,分解,在干燥器中冷却至室温、然后称重,反复进行实验,恒重操作完成的标准是连续两次称量结果相差不超过0.001 g;
(2) A试管中对CuSO4进行加热,剩余黑色粉末为CuO,用带火星的木条伸入集气瓶D,发现木条能复燃,则有O2生成,根据氧化还原反应规律,则还原产物为SO2,根据氧化还原反应中得失电子相等,可知SO2和O2的物质的量之比为2:1,反应方程式可初步写成:CuSO4![]() CuO+xSO3↑+2SO2↑+O2↑,根据质量守恒定律分析,反应生成气体的质量为50.0 g-45.0 g=5.0 g,干燥管完全吸收了SO2和SO3,其质量为74.5 g-70 g=4.5 g,生成的O2的质量为5 g-4.5 g=0.5 g,则生成硫的氧化物和生成的O2的质量比为4.5 g:0.5 g=9:1,即(80x+2×64):32=9:1,解得:x=2,所以反应方程式可写出:CuSO4
CuO+xSO3↑+2SO2↑+O2↑,根据质量守恒定律分析,反应生成气体的质量为50.0 g-45.0 g=5.0 g,干燥管完全吸收了SO2和SO3,其质量为74.5 g-70 g=4.5 g,生成的O2的质量为5 g-4.5 g=0.5 g,则生成硫的氧化物和生成的O2的质量比为4.5 g:0.5 g=9:1,即(80x+2×64):32=9:1,解得:x=2,所以反应方程式可写出:CuSO4![]() CuO+2SO3↑+2SO2↑+O2↑,根据硫原子守恒配平得:4CuSO4
CuO+2SO3↑+2SO2↑+O2↑,根据硫原子守恒配平得:4CuSO4![]() 4CuO+2SO3↑+2SO2↑+O2↑。
4CuO+2SO3↑+2SO2↑+O2↑。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
元素 | C1 | Br | I | O | O- |
电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是___________。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________。
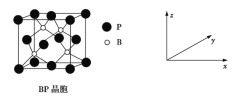
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________(填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________(填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________;Al晶体的密度为__________g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_____。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成