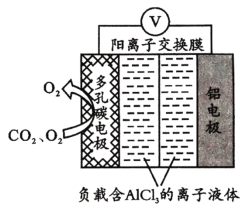
题目内容
【题目】碳化钨(WC)是大型飞机发动机关键部位材料。
(1)基态钨原子的外围电子排布式为5d46s2,有___个未成对电子。
(2)在第二周期的非金属主族元素中,第一电离能由大到小顺序为___。
(3)硫氰化钾(KSCN)俗称玫瑰红酸钾,是铁离子的检验指示剂。
①SCN-中,中心原子碳的杂化类型是___,该离子的空间构型是___。
②SCN-的等电子体分子是___(任写一个)。
(4)C3H8和纯叠氮酸(HN3)的相对分子质量相近,但C3H8常温下是气态,而纯叠氮酸常温下是一种液体,沸点为308.8K,主要原因是___。
(5)NH3的键角是107°,NF3的键角是102.5°。NF3的键角比NH3的键角小,原因是___。
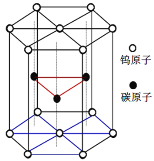
(6)碳化钨晶胞如图所示。①一个W原子与周围___个碳原子紧密相邻且等距。WC的熔点为2870℃,沸点是3000℃,硬度非常大,它的晶体类型是___。
②已知该晶胞边长为acm,高为hcm,NA为阿伏伽德罗常数。WC的摩尔质量为Mg·mol-1。该晶体密度为___g·cm-3。
【答案】4 F>N>O>C>B sp 直线型 CO2或SO2或N2O等 HN3分子间存在氢键,而C3H8分子间无氢键 氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故NF3的键角比NH3小 6 原子晶体 ![]()
【解析】
(1)根据价层电子排布分析末成对电子数;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,;
(3)①SCN-中,C的价层电子对=2+![]() =2;
=2;
②SCN-的一共有3个原子,价电子数有6+4+5+1(1个负电荷)=16个,由此找出等电子体;
(4)HN3分子间存在氢键;
(5)NF3的键角比NH3的键角小,原因是氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大;
(6)对照各类晶体的特征分析;根据ρ=![]() 计算。
计算。
(1)基态钨原子的外围电子排布式为5d46s2,5d4能级上4个电子末成对,有4个未成对电子。故答案为:4;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,在第二周期的非金属主族元素中,第一电离能由大到小顺序为F>N>O>C>B。故答案为:F>N>O>C>B;
(3)①SCN-中,C的价层电子对=2+![]() =2,中心原子碳的杂化类型是sp,该离子的空间构型是直线型。故答案为:sp;;直线型
=2,中心原子碳的杂化类型是sp,该离子的空间构型是直线型。故答案为:sp;;直线型
②SCN-的一共有3个原子,价电子数有6+4+5+1(1个负电荷)=16个,直线型,用同族替换、价电子电荷迁移等方法得:SCN-的等电子体分子是CO2或SO2或N2O等(任写一个)。故答案为:CO2或SO2或N2O等;
(4)C3H8和纯叠氮酸(HN3)的相对分子质量相近,但C3H8常温下是气态,而纯叠氮酸常温下是一种液体,沸点为308.8K,主要原因是N原子电负性较大,HN3分子间存在氢键,而C3H8分子间无氢键。故答案为:HN3分子间存在氢键,而C3H8分子间无氢键;
(5)NH3的键角是107°,NF3的键角是102.5°。N的杂化方式均为sp3,NF3的键角比NH3的键角小,原因是氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故NF3的键角比NH3小。故答案为:氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故NF3的键角比NH3小;
(6)①碳化钨WC的熔点为2870℃,沸点是3000℃,硬度非常大,它的晶体类型是原子晶体。故答案为:6;原子晶体;
②已知该晶胞边长为acm,高为hcm,NA为阿伏伽德罗常数。WC的摩尔质量为Mg·mol-1。根据均摊法:晶胞中W:12×![]() +2×
+2×![]() =3,C:3,晶胞的质量为:
=3,C:3,晶胞的质量为:![]() g,晶胞的体积为:
g,晶胞的体积为:![]() ,根据ρ=
,根据ρ=![]() , 该晶体密度为ρ=
, 该晶体密度为ρ=![]() =
=![]() g·cm-3。故答案为:
g·cm-3。故答案为:![]() 。
。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K14.3×10-7 K25.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka__(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是__(填序号);
a.CO![]() b.ClO-c.CH3COO-d.HCO
b.ClO-c.CH3COO-d.HCO![]()
(3)下列反应不能发生的是__(填序号)
a.CO![]() +CH3COOH=CH3COO-+CO2↑+H2O
+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO![]() +2HClO=CO2↑+H2O+2ClO-
+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO![]() +2HClO
+2HClO
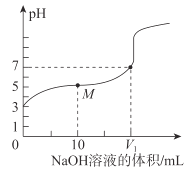
(4)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。

则HX的电离平衡常数__(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)__醋酸溶液中水电离出来的c(H+),理由是___。