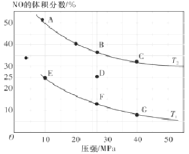
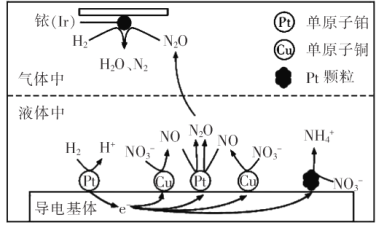
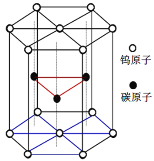
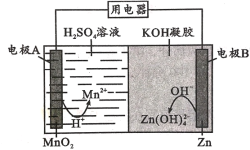
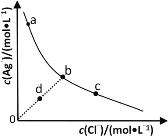
题目内容
【题目】CO2是一种廉价的碳资源,资源化利用CO2具有重要的工业与环境意义。
(1)下列物质理论上可以作为CO2捕获剂的是____(填序号)。
A.NH4Cl溶液 B.(NH4)2CO3溶液 C.氨水 D.稀H2SO4
(2)以TiO2为催化剂的光热化学循环分解CO2反应为碳减排提供了一个新途径。该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
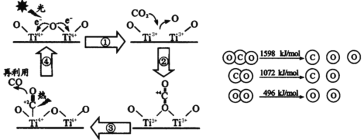
该转化过程①中会____能量(填“吸收”或“释放”);CO2分解反应的热化学方程式为______,实现该反应的能量转化方式是________。
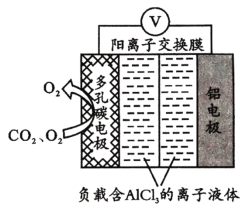
(3)O2辅助的Al-CO2电池能有效利用CO2,且电池反应产物Al2(C2O4)。是重要的化工原料,工作原理如图所示。若正极上CO2还原生成C2O![]() ,则正极的反应式为___;电路中转移1 mol电子,需消耗CO2_____L(标准状况)。
,则正极的反应式为___;电路中转移1 mol电子,需消耗CO2_____L(标准状况)。
【答案】BC 吸收 2CO2(g)═2CO(g)+O2(g) △H=+60kJ/mol 光能和热能转化为化学能 2CO2+2e-=C2O![]() 22.4
22.4
【解析】
(1)二氧化碳是酸性氧化物,具有碱性的物质均能捕获CO2,据此分析判断;
(2)根据图象,过程①中钛氧键断裂;以TiO2为催化剂、光和热条件下分解CO2反应生成CO和氧气,根据能量守恒判断能量转化方式,结合反应的焓变=反应物总键能-生成物总键能计算书写反应的热化学方程式;
(3)该原电池中Al作负极,失电子生成铝离子,正极上O2反应前后质量、化学性质不变,是催化剂,CO2还原生成C2O![]() ,据此分析解答。
,据此分析解答。
(1)二氧化碳是酸性氧化物,具有碱性的物质均能捕获CO2,反应如下:(NH4)2CO3+CO2+H2O=2 NH4HCO3,NH3·H2O+CO2= NH4HCO3,NH4Cl溶液与稀H2SO4是酸性溶液,与二氧化碳都不能发生反应,故答案为:BC;
(2)根据图象,过程①中钛氧键断裂会吸收能量,以TiO2为催化剂、光和热条件下分解CO2反应生成CO和氧气,根据能量守恒定律知,该反应中,光能和热能转化为化学能,反应的焓变=反应物总键能-生成物总键能,焓变与其方程式计量数成正比,则该反应的热化学方程式为2CO2(g)═2CO(g)+O2(g) △H=(1598-1072-496)kJ/mol×2=+60kJ/mol,故答案为:吸收;2CO2(g)═2CO(g)+O2(g) △H=+60kJ/mol;光能和热能转化为化学能;
(3)该原电池中Al作负极,失电子生成铝离子,电极反应式为Al-3e-=Al3+(或2Al-6e-=2Al3+),根据图示,正极上O2是辅助反应的发生,是催化剂,电池的正极反应式为:2CO2+2e-=C2O![]() ,电池总反应为2Al+6CO2═Al2(C2O4)3,反应中转移6个电子,因此当电路中转移1 mol电子,需消耗1molCO2,在标准状况下的体积为22.4L,故答案为:2CO2+2e-=C2O
,电池总反应为2Al+6CO2═Al2(C2O4)3,反应中转移6个电子,因此当电路中转移1 mol电子,需消耗1molCO2,在标准状况下的体积为22.4L,故答案为:2CO2+2e-=C2O![]() ;22.4。
;22.4。

【题目】纯碱是玻璃、制皂、造纸、纺织和漂染等工业的基本原料。
Ⅰ.世界最早工业生成纯碱的方法是路布兰(N.Leblanc)法,其流程如图:

(1)流程Ⅰ的反应是___反应(填“氧化还原”或“非氧化还原"),流程Ⅱ的反应是分步进行的,a.Na2SO4(s)与过量木炭反应生成Na2S(s);b.Na2S(s)与石灰石发生复分解反应生成Na2CO3,a步的反应化学方程式为___。
Ⅱ.19世纪60年代后生产纯碱的路布兰法被索尔维(E.Solvay)氨碱法所取代,其生产流程如图:
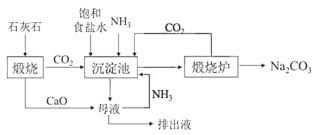
(2)氨碱法中加入NH3的主要作用是___。
(3)与路布兰法相比,氨碱法的优点有___。(写出一条即可)
Ⅲ.1939年候德榜首先提出并自行设计了联合制碱法——利用合成氨工业上的NH3和CO2和NaCl为原料生产纯碱。
(4)侯德榜制碱法的关键还在于对从反应后的混合物中分离出NaHCO3后所得溶液的处理:在溶液中加入NaCl固体并通入NH3,并在___(填温度范围)下析出NH4Cl。
表1不同温度下NaCl和NH4Cl的溶解度数据(g/100g水)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |