题目内容
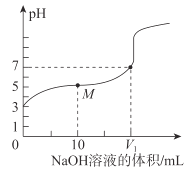
【题目】25℃时,用0.1molL-1NaOH溶液滴定20mL0.1molL-1CH3COOH溶液,溶液的pH随加入NaOH溶液体积的变化如图。下列说法不正确的是( )
A.0.1molL-1CH3COOH溶液中,由水电离出的c(H+)<10-7molL-1
B.V1<20
C.M点溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.二者等体积混合时,c(Na+)=c(CH3COO-)+c(OH-)
【答案】D
【解析】
由图像可知,没加入氢氧化钠时,0.1molL-1CH3COOH溶液的pH=3,随着氢氧化钠的加入,pH逐渐增大,当加入氢氧化钠V1时,pH=7,然后分析。
A.0.1molL-1CH3COOH溶液中,pH=3,c(H+)=10-3molL-1,c(OH-)=![]() =
=![]() =10-11molL-1,由水电离出的c(H+)=c(OH-)=10-11molL-1<10-7molL-1,故A正确;
=10-11molL-1,由水电离出的c(H+)=c(OH-)=10-11molL-1<10-7molL-1,故A正确;
B.0.1molL-1NaOH溶液滴定20mL0.1molL-1CH3COOH溶液,若V1=20mL,得到的是醋酸钠溶液,显碱性,pH>7,要使pH=7,需酸过量,V1<20mL,故B正确;
C.M点溶液中溶质为等物质的量的醋酸和醋酸钠,混合溶液的pH<7,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒:c(Na+)+ c(H+)=c(OH-)+c(CH3COO-),c(Na+)<c(CH3COO-),电离和水解程度都很小,故存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.二者等体积混合时,得到的是醋酸钠溶液,显碱性,c(OH-)>c(H+),根据电荷守恒:c(Na+)+ c(H+)=c(OH-)+c(CH3COO-),c(Na+)<c(CH3COO-)+c(OH-),故D错误;
答案选D。

 阅读快车系列答案
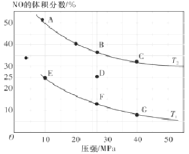
阅读快车系列答案【题目】已知25℃时,几种常见弱酸的Ka如下表所示:
电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
电离常数(molL-1) | K1=5.6×10-2 K2=5.4×10-3 | K=1.7×10-5 | K=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
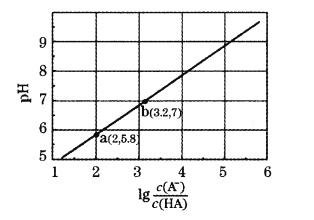
(1)草酸(H2C2O4)是一种___(填“一元”、“二元”、“多元”)弱酸。25℃时,0.1molL-1的Na2C2O4、CH3COONa、NaCN、Na2CO3溶液的pH由大到小的顺序是__。
(2)KHC2O4溶液呈酸性,向10mL0.01molL-1的H2C2O4溶液滴加0.01molL-1KOH溶液V(mL)。回答下列问题:
①当V<10mL时,反应的离子方程式为___。
②当V=10mL时,溶液中![]() 、
、![]() 、H2C2O4、H+的浓度由大到小的顺序为__。
、H2C2O4、H+的浓度由大到小的顺序为__。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(![]() )+c(
)+c(![]() );当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(
);当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(![]() )+c(
)+c(![]() )+c(H2C2O4);则a__b(填“<”“=”或“>”).
)+c(H2C2O4);则a__b(填“<”“=”或“>”).
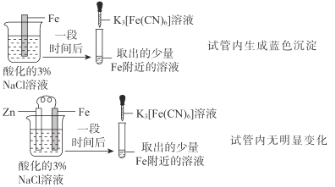
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A |
| Zn保护了Fe不被腐蚀 |
B |
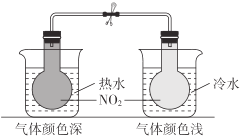
| 2NO2(g)N2O4(g)为吸热反应 |
C |
| 木炭与浓硝酸发生了反应 |
D |
| 碳酸钠的水解程度强 |
A.AB.BC.CD.D