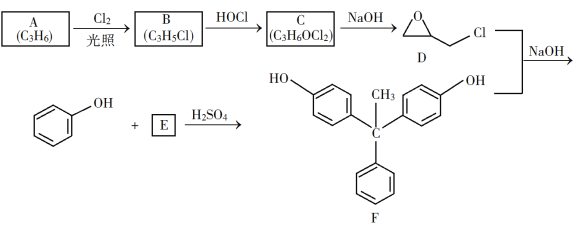
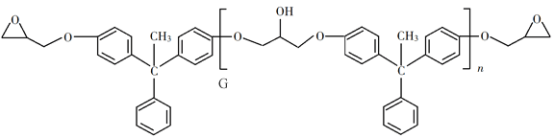
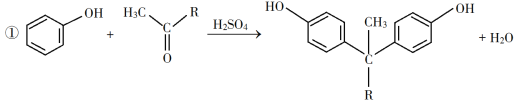
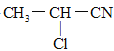题目内容
【题目】物质结构与性质下表为元素周期表的一部分。请回答下列问题:

(1)上述元素中,属于s区的是_________(填元素符号)。
(2)写出元素⑨的基态原子的价电子排布图_______。
(3)元素的第一电离能:③______④(选填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为____;该分子为___分子(选填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________。
(5)元素⑥的单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
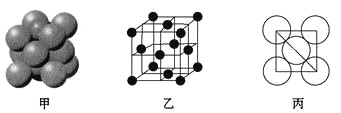
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为____________,该晶体的密度为___________(用字母表示)。
【答案】H、Mg、Ca 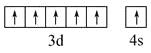 大于 四面体形 极性 先产生蓝色沉淀,后溶解得深蓝色溶液 12
大于 四面体形 极性 先产生蓝色沉淀,后溶解得深蓝色溶液 12 ![]() g·cm-3(或
g·cm-3(或 g·cm-3)
g·cm-3)
【解析】
(1)区的名称来自于按照构造原理最后填入电子的轨道名称,因此上述元素中,属于s区的是H、Mg、Ca;
(2)元素⑨是Cr,原子序数是24,所以根据核外电子排布规律可知基态原子的价电子排布图为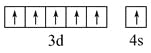 ;
;
(3)③④分别是N和O,非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,第一电离能大于氧元素,则元素的第一电离能:③大于④;
(4)元素③气态氢化物是氨气,其中氮元素含有1对孤对电子,价层电子对数是3,所以的VSEPR模型为四面体形;由于实际构型是三角锥形,所以该分子为极性分子。氨气能与铜离子形成配位健,则向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为先产生蓝色沉淀,后溶解得深蓝色溶液;
(5)元素⑥是Al,根据晶胞结构可知以顶点为中心,与该点距离最近的铝原子有12个,所以晶胞中⑥原子的配位数为12;若已知⑥的原子半径为dcm,则面对角线是4dcm,则边长是![]() ,体积是
,体积是![]() 。晶胞中铝原子的个数=
。晶胞中铝原子的个数=![]() ,则该晶体的密度为
,则该晶体的密度为![]() =
= g·cm-3。
g·cm-3。

 阅读快车系列答案
阅读快车系列答案【题目】下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
X | ||
Y | ||
Z | M |
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子排布图为![]()