题目内容
15.CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为,5.6×10 -5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为2×10-4mol/L.分析 Na2CO3溶液的浓度为5.6×10 -5mol/L,等体积混合后溶液中c(CO32-)=2.8×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:Na2CO3溶液的浓度为5.6×10 -5mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×5.6×10-5mol/L=2.8×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{2.8×1{0}^{-5}}$mol/L=1×10-4mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×1×10-4mol/L=2×104mol/L.
故答案为:2×10-4mol/L.
点评 本题考查溶度积的有关计算,难度中等,注意计算时容易忽略混合后溶液的浓度发生变化.

练习册系列答案
相关题目
3.能使水的电离平衡正向移动,而且所得溶液呈酸性的是( )
| A. | 将水加热到100℃时,水的pH=6 | B. | 向水中滴加少量稀H2SO4 | ||
| C. | 向水中加入少量NaHCO3 | D. | 向水中加入少量胆矾晶体 |
7.Cu与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示:下列有关判断正确的是( )
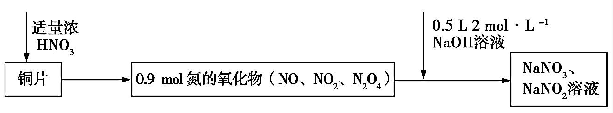

| A. | 若铜片为51.2 g,则生成0.2 mol NaNO3 | |
| B. | 常温下,Cu 遇浓硝酸发生钝化,不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16 L | |
| D. | 反应过程中生成的Cu(NO3)2 既是氧化产物,也是还原产物 |
4.下列说法错误的是( )
| A. | 实验室中少量金属钠通常保存在煤油中 | |
| B. | 光线通过时,胶体可产生丁达尔效应 | |
| C. | 氧气、液氯是单质,氯水、氯化氢、纯碱是化合物. | |
| D. | “只要工夫深,铁杵磨成针”只涉及物理变化 |
5.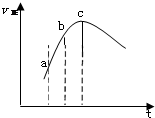 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)?SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示.则正确的结论是( )
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)?SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示.则正确的结论是( )
 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)?SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示.则正确的结论是( )
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)?SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示.则正确的结论是( )| A. | 逆反应速率:a点大于点c | |
| B. | 反应物浓度:a点小于点b | |
| C. | 反应在c点时SO2的转化率最大 | |
| D. | 反应物的总能量低于生成物的总能量 |
 ,
,
 .E可以进行喷泉实验的主要原因是:因为NH3极易溶于水.
.E可以进行喷泉实验的主要原因是:因为NH3极易溶于水. NH3.H2O+H+
NH3.H2O+H+
 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.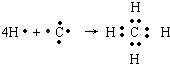 .
.