题目内容
5.结构决定性质,性质决定用途;已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,Z的单质在常温下均为无色气体,W原子的最外层电子排布是nsn npn+2,Y原子的最外层电子数是内层电子数的2倍.试回答:(1)写出W元素的元素符号和该原子基态的电子排布式:O,1s22s22p4
(2)写出Z元素的原子结构示意图和该原子基态的电子排布图:
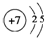 ,
,
(3)X单质和Z单质在一定条件下反应生成化合物E,则E的电子式是:
 .E可以进行喷泉实验的主要原因是:因为NH3极易溶于水.
.E可以进行喷泉实验的主要原因是:因为NH3极易溶于水.(4)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为NH4++H2O
 NH3.H2O+H+
NH3.H2O+H+(5)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序)为碳酸氢铵(写名称),该化合物的浓溶液与足量NaOH热浓溶液反应的离子方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O.
分析 X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子形成的离子就是一个质子,则X是H元素;Y原子的最外层电子数是内层电子数的2倍,最外层电子不能超过8,只能有2个电子层,最外层电子数为4,则Y是C元素;W原子的最外层电子排布是nsn npn+2,则n=2,故W为O元素,Z、W在元素周期表中处于相邻的位置,Z的单质在常温下为无色气体,则Z为N元素,据此解答.
解答 解:X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子形成的离子就是一个质子,则X是H元素;Y原子的最外层电子数是内层电子数的2倍,最外层电子不能超过8,只能有2个电子层,最外层电子数为4,则Y是C元素;W原子的最外层电子排布是nsn npn+2,则n=2,故W为O元素,Z、W在元素周期表中处于相邻的位置,Z的单质在常温下为无色气体,则Z为N元素.
(1)W为O元素,该原子基态的电子排布式:1s22s22p4,故答案为:O,1s22s22p4;
(2)Z为N元素,原子结构示意图为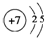 ,原子基态的电子排布图:
,原子基态的电子排布图: ,
,
故答案为: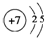 ,
, ;
;
(3)氢气和氮气在一定条件下反应生成化合物E为NH3,则NH3的电子式是: ,NH3可以进行喷泉实验的主要原因是:因为NH3极易溶于水,
,NH3可以进行喷泉实验的主要原因是:因为NH3极易溶于水,
故答案为: ;因为NH3极易溶于水;
;因为NH3极易溶于水;
(4)仅由H、N、O三种元素组成的某种盐是一种速效肥料,该盐为NH4NO3,但长期施用会使土壤酸化,有关的离子反应方程式为:NH4++H2O  NH3.H2O+H+,
NH3.H2O+H+,
故答案为:NH4++H2O  NH3.H2O+H+;
NH3.H2O+H+;
(5)这四种元素可组成原子个数比为5:1:1:3的化合物(按H、C、N、O的顺序)为NH4HCO3,名称为碳酸氢铵,该化合物的浓溶液与足量NaOH热浓溶液反应的离子方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,
故答案为:碳酸氢铵;NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O.
点评 本题考查位置结构性质的关系及应用,推断元素的是解答的关键,侧重对化学用语的考查,需要学生熟练掌握元素化合物性质,难度中等.

| A. | 常温常压下,11.2L一氧化碳分子数是0.5NA | |
| B. | NA个氧气分子和NA个氮气分子的质量比为7:8 | |
| C. | 常温常压下,2.86gNa2CO3•10H2O含有的Na+数为0.02NA | |
| D. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA |
 实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H3PO4(浓)+NaH2PO4+HBr、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H3PO4(浓)+NaH2PO4+HBr、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O有关数据见下表:
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)B中进水口为b(填“a”或“b”)口.
(3)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓磷酸顺利流下.
(4)制取氢溴酸时,为什么不能用浓H2SO4代替浓磷酸?2HBr+H2SO4(浓)=Br2+SO2↑+2H2O(用化学方程式表示).
(5)将C中的馏出液转入三角烧瓶中,边振荡边逐滴滴入浓H2SO4以除去水等杂质,滴加浓硫酸约1~2mL,使溶液明显分层,再用分液漏斗分去硫酸层,将经硫酸处理后的溴乙烷转入蒸馏瓶,水浴加热蒸馏,收集到35~40℃馏分约10.0g,从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
干海带$\stackrel{焙烧}{→}$海带灰$\stackrel{水}{→}$水溶液$\stackrel{氧化}{→}$$\stackrel{A}{→}$$\stackrel{B}{→}$→碘单质
下列有关叙述不正确的是( )
| A. | 碘元素在海水中没有游离态存在 | |
| B. | 在提取的过程中用的氧化剂可以是H2O2 | |
| C. | 操作A是萃取 | |
| D. | B是提纯操作,常用蒸馏 |

 .
.