题目内容
7.Cu与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示:下列有关判断正确的是( )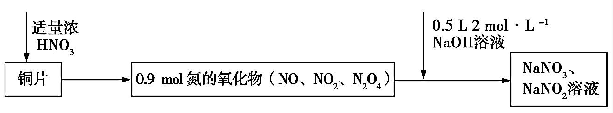
| A. | 若铜片为51.2 g,则生成0.2 mol NaNO3 | |
| B. | 常温下,Cu 遇浓硝酸发生钝化,不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16 L | |
| D. | 反应过程中生成的Cu(NO3)2 既是氧化产物,也是还原产物 |
分析 A、n(Cu)=$\frac{51.2g}{64g/mol}$=0.8mol,n(NaOH)=0.5L×2mol/L=1mol,由终态分析法容易看出只有两种元素的价态有变化,其一是Cu→Cu(NO3)2,Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2,N元素由+5价降低为+3价,每个N原子得2个电子,由电子转移守恒可知,51.2gCu失去的电子等于HNO3到NaNO2得到的电子,据此计算故产物中NaNO2的物质的量,由Na守恒可知n(NaOH)=n(NaNO2)+n(NaNO3),据此计算NaNO3的物质的量;
B、常温下,金属铜遇到浓硝酸发生钝化,该反应会发生;
C、根据公式V=nVm进行计算;
D、氧化还原反应中,化合价升高元素对应产物是氧化产物,化合价降低元素对应产物是还原产物.
解答 解:A、n(Cu)=$\frac{51.2g}{64g/mol}$=0.8mol,n(NaOH)=0.5L×2mol/L=1mol,由电子守恒可知,51.2gCu失去的电子等于HNO3到NaNO2得到的电子,则0.8mol×(2-0)=n(NaNO2)×(5-3),解得n(NaNO2)=0.8mol,由Na原子守恒可知n(NaOH)=n(NaNO2)+n(NaNO3),则n(NaNO3)=1mol-0.8mol=0.2mol,故A正确;
B、常温下,Cu遇浓硝酸发生钝化,但是钝化不是不反应,可能发生上述反应,故B错误;
C、标准状况下得到的0.9mol氮氧化物的体积是0.9mol×22.4L/mol=20.16L,故C正确;
D、反应过程中生成的Cu(N03)2是氧化产物,不是还原产物,故D错误.
故选AC.
点评 本题考查氧化还原反应的计算,为高频考点,把握硝酸的作用、N元素的化合价变化及原子守恒、电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度较大.

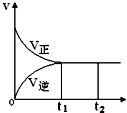 可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )
可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )| A. | t1~t2,各物质的浓度不再发生变化 | |
| B. | t2时刻升高温度,反应物转化率不会改变 | |
| C. | t2时刻增大N2的浓度,可提高H2的转化率 | |
| D. | 使用催化剂可加快反应速率,提高生产效率 |
| 物质 | 粒子数(个) | 质量(g) | 物质的量(mol) | 摩尔质量(g/mol) |
| 氦气 | 0.3 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H22O11 | 0.25 |
| A. | 2.3 g Na和足量的O2完全反应,生成3.4g固体混合物,转移电子数为0.1NA | |
| B. | 电解精炼铜时,当阳极减少64g金属时转移的电子数为2NA | |
| C. | 46 g的NO2与46 g的N2O4含有的原子数不同 | |
| D. | 标准状况下,11.2 L苯中含有碳碳双键数目为3NA |
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO).c(S{O}_{3})}{c(N{O}_{2}).c(S{O}_{2})}$的值及SO2转化率不变 |
| A. | 化合反应和分解反应一定是氧化还原反应 | |
| B. | CO2+H2O=H2CO3 是化合反应但不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应,复分解反应不可能属于氧化还原反应 | |
| D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 不是置换反应但是氧化还原反应 |