题目内容
【题目】硫—碘循环分解水制氢主要涉及下列反应:
① SO2+2H2O+I2===H2SO4+2HI ② 2HI![]() H2+I2 ③ 2H2SO4 === 2SO2+O2+2H2O
H2+I2 ③ 2H2SO4 === 2SO2+O2+2H2O
(1)整个过程中SO2、I2的作用是______。
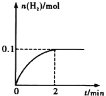
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应②,已知H2的物质的量随时间的变化如图所示,则在0~2 min内的平均反应速率v (HI) =______;
(3)已知拆开1 mol H—I键需要消耗298kJ能量,形成1mol H—H键能够释放436kJ能量,形成1mol I—I键能够释放151kJ能量,则在反应②中,分解0.2mol HI时会______(填“吸收”或“释放”)______kJ能量。
(4)实验室用Zn和硫酸制H2,为了加快反应速率下列措施不可行的是__(填序号)
a.加入浓硝酸 b.加入少量CuSO4 固体 c.用粗锌代替纯锌 d.加热 e.把锌粒弄成锌粉 f.用98.3%的浓硫酸
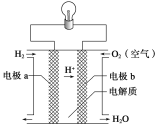
(5)氢气可用于制燃料电池,某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-== 2H2O ,B极:O2+4e-== 2O2-,则A极是电池的___极;电子从该极___(填“流入”或“流出”)。
【答案】催化作用(或催化剂或加快反应速率) 0.1mol/(L·min) 吸收 0.9 a、f 负极 流出
【解析】
(1)由题干提供的反应过程看出,SO2、I2参加了反应但没有消耗,所以整个过程中SO2、I2的作用是催化剂;
故答案为:催化剂;
(2)由图示知2min内,氢气的物质的量由0变为0.1mol,v(H2)=c(H2)/t=![]() =0.05mol/(Lmin),由方程式2HI H2+I2得v(HI)= 2v(H2)= 0.05mol/(Lmin)×2=0.1mol/(Lmin);
=0.05mol/(Lmin),由方程式2HI H2+I2得v(HI)= 2v(H2)= 0.05mol/(Lmin)×2=0.1mol/(Lmin);
故答案为:0.1mol/(Lmin);
(3)由方程式2HI H2+I2得,分解0.2mol的HI时,断开化学键吸收的能量为:298kJ×0.2=59.6kJ,形成化学键释放的能量为:436kJ×0.1+151kJ×0.1=58.7 kJ,吸收的能量大于释放的能量,所以该反应吸收能量,大小为59.6kJ-58.7kJ=0.9 kJ;
故答案为:吸收,0.9;
(4)a.浓硝酸属于强氧化性酸,与锌反应不生成氢气,故a不可行;
b.加入少量CuSO4 固体,锌置换出铜,构成了原电池,反应加快,故b可行;
c.用粗锌代替纯锌,杂质与锌构成了原电池的两极,形成原电池,反应加快,故c可行;
d.温度升高,反应加快,故d可行;
e.把锌粒弄成锌粉,增大了接触面积,反应加快,故e可行;
f.98.3%的浓硫酸具有强氧化性,与锌反应不生成氢气,故f不可行;
故答案为:a、f;
(5)由电极反应得,A极失去电子,是电池的负极;电子从负极流出;
故答案为:负极;流出。

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
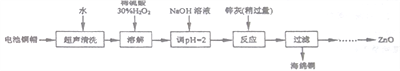
(1)①铜帽溶解时加入H2O2的目的是___________________(用化学方程式表示)。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是_________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为_____________,滴定终点观察到的现象为_________________。
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会__________(填“偏高”“ 偏低”“ 不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Fe 2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol·L-1HNO3、1.0mol·L-1NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:
①向滤液中加入___________使其充分反应;②滴加1.0mol·L-1的氢氧化钠,调节3.2≤pH<5.9,使___________沉淀完全;③过滤;④向滤液中滴加1.0 mol·L-1的氢氧化钠,调节pH为________≤pH≤_______,使Zn2+沉淀完全,⑤过滤、洗涤、干燥;⑥900℃煅烧。