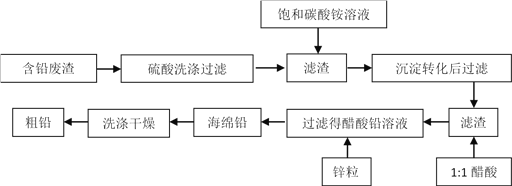
��Ŀ����
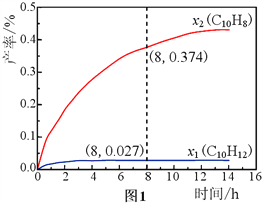
����Ŀ��N2O��CO�ǻ�����Ⱦ�����壬����Pt2O+����ת��Ϊ�����壬�䷴ӦΪ:N2O(g)+CO(g)![]() CO2(g)+N2(g)��H���йػ�ѧ��Ӧ�����ʱ仯������ͼ1�������仯������ͼ2������˵����ȷ����
CO2(g)+N2(g)��H���йػ�ѧ��Ӧ�����ʱ仯������ͼ1�������仯������ͼ2������˵����ȷ����
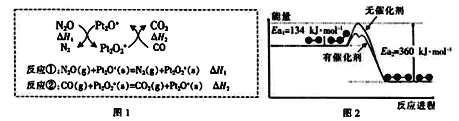
A. ��ͼ1��֪:��H1=��H+��H2
B. ��ͼ2��֪:��H=-226kJ/mol
C. ��ͼ2��֪:��Ӧ�ٵķ�Ӧ���ʱȷ�Ӧ�ڿ�
D. Ϊ��ʵ��ת���費����Ӧ���в���Pt2O+��Pt2O2+
���𰸡�B
��������A.��N2O+Pt2O+=Pt2O2++N2��H1����Pt2O2++CO=Pt2O++CO2��H2����ϸ�˹���ɼ����+�ڵõ�N2O(g)+CO(g)=CO2(g)+N2(g)��H=��H1+��H2������H1=��H-��H2����A����B. ��ͼ2������֪����Ӧ�����������������ӦΪ���ȷ�Ӧ����Ӧ�ʱ���H=������������-��Ӧ��������=135kJ/mol-359kJ/mol=-226kJ/mol����B��ȷ��C. ��ͼ2�д�����ͼ���֪����Ӧ�ٵĻ�ܴ��ڷ�Ӧ������ͬ�����£���Ӧ�Ļ��Խ��Ӧ����Խ������Ӧ�ٵķ�Ӧ���ʱȷ�Ӧ��������C����D. ��N2O+Pt2O+=Pt2O2++N2��H1����Pt2O2++CO=Pt2O++CO2��H2����Ӧ������Pt2O+��Pt2O2+ ���뷴Ӧ�������ɲ���Ҫ���䣬��D����ѡB��

 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�