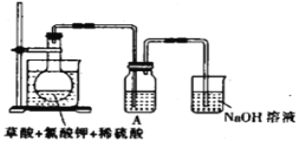
题目内容
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素基态原子的价层电子排布式为_____________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Y的曲线是_________(填标号)。
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/676db9e64b15468faa67ccb9aa300976.png]
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型分别是_____________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为________________。
(5)某R的氧化物立方晶胞结构如图所示,该物质的化学式为____________。(用元素符号表示),已知该晶体密度为ρg/cm3,距离最近的原子间距离为dpm,则R的相对原子质量为____________。(阿伏加德罗常数为NA)
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/02395761f35f4972ad3c8807ad342892.png]
【答案】 4s24p2 C sp、sp2 25︰1 三角锥形 GeO ![]()
【解析】本题是物质结构与性质的综合题,需要熟练掌握这一部分涉及的主要知识点,一般来说,题目都是一个一个小题独立出现的,只要按照顺序进行判断计算就可以了。
X原子有3个能级,且每个能级上的电子数相等,所以只能是1s22s22p2,所以X为C。X、Y、R三元素在周期表中同族,所以Y为Si,R为Ge。根据Z有气态氢化物得到Z为非金属,所以Z只能是P、S、Cl、Ar中的一个,根据不成对电子最多,得到Z为P(其3p上有3个单电子)。
(1)R为Ge,处于周期表的第4周期ⅣA族,所以价层电子排布式为:4s24p2。
(2)C、Si、Ge从上向下半径增大,第一电离能逐渐减小,所以c为Ge的电离能曲线。
(3)CH2=C=O中第一个C形成一个双键,所以是sp2杂化;第二个C形成两个双键所以是sp杂化。单键一定是σ键,双键一定是一个σ键和一个π键,分子为(CH3CH2O)3P=O,其中的CH3CH2O-基团都是单键,只有P=O一个双键,所以分子中的σ为3×(5+1+1+1)+1=25个(每个CH3CH2O-中有5个C-H,1个C-C,1个C-O,1个O-P;还要计算分子中P=O里的1个σ键)。π键只有1个,所以答案为:25:1。
(4)P的最外层有5个电子,达到8电子稳定结构应该形成3个共价键,所以该化合物为PCl3。根据价层电子对互斥理论,中心原子P的价电子对为3+(5-1×3)/2=4对,其中一对为孤电子对,所以是三角锥结构。
(5)氧原子占据晶胞的8个顶点和6个面心,所以一共有8×1/8+6×1/2=4个,Ge都在晶胞内部,也有4个,所以化学式为GeO。距离最近的原子间距离为dpm,明显指的是最近的O和Ge原子的距离,根据晶体的结构,这个距离是晶胞的体对角线的1/4,所以体对角线长度为4d pm,进而得到晶胞边长为![]() pm。所以晶胞的体积为边长的立方,为
pm。所以晶胞的体积为边长的立方,为![]() pm3=
pm3=![]() cm3。所以晶胞的质量为
cm3。所以晶胞的质量为![]() g。因为一个晶胞中有4个GeO,所以1个GeO的质量为
g。因为一个晶胞中有4个GeO,所以1个GeO的质量为![]() g;1molGeO的质量为
g;1molGeO的质量为 ![]() g,即GeO的分子量为
g,即GeO的分子量为![]() ,所以Ge原子量为
,所以Ge原子量为![]()

【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
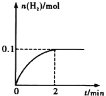
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 03 min内用CH3OH表示的反应速率v(CH3OH)=________mol L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①常温下A、C溶液pH均大于7,B溶液pH小于7,D溶液pH等于7;
②C溶液和D溶液混合只产生白色沉淀;
③B溶液和C溶液混合共热时只产生刺激性气味的气体;
④A溶液和D溶液混合时无明显现象。
请回答:
(1)D的化学式_______________________。
(2)实验③反应的离子方程式_______________________。
(3)从B、C、D中选取物质,设计实验方案确定A的组成_______________________。