题目内容
【题目】(I)按要求回答下列问题:
(1)在一定的温度和压强下,2 体积 X Y 2 (g)跟 3 体积Z2(g)化合生成 2 体积气态化合物,则该气态化合物的化学式是 _________(用X、Y、Z表示)
(2)用KMnO4氧化盐酸,其反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是________。当有1mol KMnO4和一定量盐酸恰好完全反应,反应后溶液的体积为2L ,则所得溶液中Cl—的物质的量浓度为_______,被氧化的HCl的物质的量为________。
(II)现有下列物质:①H2O、②空气、③Mg、④CaCO3、⑤H3PO4、⑥CuSO4﹒5H2O、⑦浓硝酸、⑧无水酒精、⑨硫酸、⑩盐酸。
其中,属于电解质的是____________(填序号,下同);属于非电解质的是____________;属于强电解质的是____________;能导电的是____________。
【答案】XY2Z3 KMnO4 1.5mol·L-1 5mol ①④⑤⑥⑨ ⑧ ④⑥⑨ ③⑦⑩
【解析】
(1)由阿伏加德罗定律可推知,相同温度和压强下,参加反应的气体的体积比等于相应化学计量数之比;
(2)根据氧化还原反应的概念分析。
(3)根据电解质、非电解质、强电解质等相关概念分析解答。
(I)、(1)由题意可知,XY2(g)、Z2(g)和生成的气态化合物的体积比=2:3:2,因为相同温度和压强下,参加反应的气体的体积比等于相应化学计量数之比,即化学方程式中,XY2(g)、Z2(g)和生成的气态化合物的计量数之比为2:3:2,根据原子守恒,生成的气态化合物的化学式为XY2Z3,其反应方程式为2XY2(g)+3Z2(g)=2XY2Z3。
(2)分析反应方程式中元素化合价的变化知:锰元素的化合价由KMnO4中的+7价降到MnCl2中的+2价,反应中得到电子,所以KMnO4的氧化剂。根据反应方程式的计量关系可知,1molKMnO4恰好反应需要8molHCl,生成1molKCl和1molMnCl2,所得溶液中Cl-的物质的量=1mol×1+1mol×2=3mol,则所得溶液中Cl-的物质的量浓度=![]() =1.5mol/L。根据氯元素化合价的变化知,8molHCl中只有5molCl-的化合价升高,发生氧化反应,所以8molHCl中被氧化的HCl的物质的量为5mol。
=1.5mol/L。根据氯元素化合价的变化知,8molHCl中只有5molCl-的化合价升高,发生氧化反应,所以8molHCl中被氧化的HCl的物质的量为5mol。
(II)、在水溶液中或熔融状态下能够导电的化合物叫做电解质,酸、碱、盐都是电解质,所以属于电解质的是①H2O、④CaCO3、⑤H3PO4、⑥CuSO4﹒5H2O、⑨硫酸。在水溶液中和熔融状态下都不能导电的化合物叫做非电解质,所以属于非电解质的是⑧无水酒精。在水溶液中完全电离的电解质称为强电解质,故属于强电解质的有④CaCO3、⑥CuSO4﹒5H2O、⑨硫酸。能导电的有③Mg、⑦浓硝酸、⑩盐酸。

【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①常温下A、C溶液pH均大于7,B溶液pH小于7,D溶液pH等于7;
②C溶液和D溶液混合只产生白色沉淀;
③B溶液和C溶液混合共热时只产生刺激性气味的气体;
④A溶液和D溶液混合时无明显现象。
请回答:
(1)D的化学式_______________________。
(2)实验③反应的离子方程式_______________________。
(3)从B、C、D中选取物质,设计实验方案确定A的组成_______________________。
【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O能否反应产生Cl2。
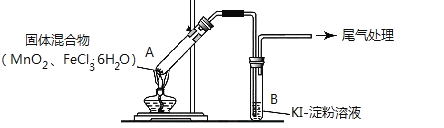
实验操作和现象如下表:
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
(1)实验1和实验2产生白雾的原因是___________________________。
(2)实验2说明黄色气体中含有___________(填化学式)则实验1中③的现象也可能是发生了另一个离子反应,则其离子方程式为______________________________。
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B 间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中淀粉KI溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+。
则方案1中C中盛放的试剂是_________________;方案2中检验 Fe2+的试剂名称是____________,选择NaBr溶液的依据是__________________。
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________。请你设计实验方案验证此猜想__________________________。