题目内容
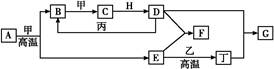
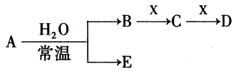
已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F、M为中学常见的氧化物,E是磁铁矿的主要成分(是黑色固体);H、K为中学常见的盐;M是一种常见的无色液体。各物质间的转化关系如下图所示(某些条件已略去)。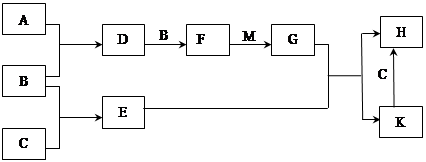
请回答:
(1)物质H的化学式为 。
(2)由F与M作用生成G的化学反应基本类型为 。
(3)A与C在加热条件下反应的化学方程式为: 。
(4)G的浓溶液在加热条件下能跟C反应,该反应中G体现了 (填序号)。
A.氧化性 B.还原性 C.漂白性 D.酸性
(5)若先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为 。
(6)H溶液在空气中长期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因: 。
(1)FeSO4 (2)化合反应 (3)Fe+S FeS
FeS
(4)A D (只填1个不给分)(1—4各1分)
(5)先无明显现象,通入NH3后产生白色沉淀 (各1分,共2分)
(6)4Fe2+ + O2 + 10H2O = 4Fe(OH)3 + 8H+ 或 4Fe2+ +8OH-+ O2 + 2H2O= 4Fe(OH)3(2分,答案合理即可)
解析试题分析:A为淡黄色固体且是单质则为硫;E是磁铁矿的主要成分(是黑色固体)则为四氧化三铁;由转化关系可知B为氧气,D为二氧化硫,F为三氧化硫,M为水,G为硫酸,H、K为中学常见的盐;分别为硫酸亚铁和硫酸铁。故(1)物质H的化学式为FeSO4 。(2)由F与M作用生成G的化学反应基本类型为化合反应 。(3)A与C在加热条件下反应的化学方程式为Fe+S FeS 。(4)浓硫酸和铁反应生成硫酸铁,二氧化硫和水,体现了硫酸的氧化性和 酸性。(5) 二氧化硫气体通入BaCl2溶液中不反应但有部分会溶解在水中,再通入NH3由于生成了铵根离子和亚硫酸根离子,最终生成了亚硫酸钡沉淀,实验过程中的现象为表述为先无明显现象,通入NH3后产生白色沉淀。(6)二价铁离子会在空气中被氧化为三价铁离子,再发生水解,生成红褐色浑浊物是氢氧化铁,用一个离子方程式表示其变化的原因:4Fe2+ + O2 + 10H2O = 4Fe(OH)3 + 8H+ 或 4Fe2+ +8OH-+ O2 + 2H2O= 4Fe(OH)3。
FeS 。(4)浓硫酸和铁反应生成硫酸铁,二氧化硫和水,体现了硫酸的氧化性和 酸性。(5) 二氧化硫气体通入BaCl2溶液中不反应但有部分会溶解在水中,再通入NH3由于生成了铵根离子和亚硫酸根离子,最终生成了亚硫酸钡沉淀,实验过程中的现象为表述为先无明显现象,通入NH3后产生白色沉淀。(6)二价铁离子会在空气中被氧化为三价铁离子,再发生水解,生成红褐色浑浊物是氢氧化铁,用一个离子方程式表示其变化的原因:4Fe2+ + O2 + 10H2O = 4Fe(OH)3 + 8H+ 或 4Fe2+ +8OH-+ O2 + 2H2O= 4Fe(OH)3。
考点:本题考查了无机框图中未知物的推断和相关化学反应方程式的书写。

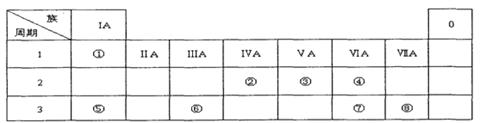
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② | | | |
| | | ⑦ | ⑧ |
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是 ,②元素的氧化物的电子式是 ,②与⑧形成的化合物中存在的化学键是 ,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是 (用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是 (用离子符号填)。
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:
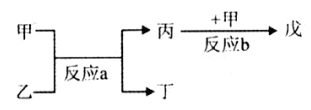
①写出反应a的化学方程式: 。
②写出戊与丁反应的化学方程式: 。
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。
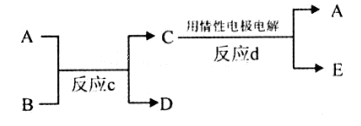
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为: 。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为 。