题目内容
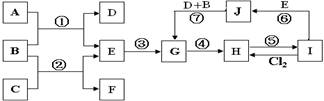
物质A~F有如图所示的转化关系。已知A、B、C均为单质,且室温下A为用途广泛的金属、B为黄绿色气体、C为密度最小的无色气体,E为气体,E溶液呈强酸性且无色,D溶液呈黄色。
请回答下列问题:
(1)写出下列物质的化学式:A 、B 、C 、D 、E 、F 。
(2)写出反应②的化学方程式: 。
(3)写出反应③的离子方程式: 。
(1)A:Fe B:Cl2 C:H2 D:FeCl3 E:HCl F:FeCl2
(2)H2+Cl2 2HCl (3)2Fe2+ +Cl2=2Fe3++2Cl-
2HCl (3)2Fe2+ +Cl2=2Fe3++2Cl-
解析试题分析::B为黄绿色气体,应为Cl2,单质A为用途广泛的金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,E溶液与A产物为FeCl2和H2,故F溶液为氯化亚铁溶液。则(1)A: Fe B: Cl2 C: H2 D: FeCl3 E: HCl F:FeCl2
(2)②反应为氢气与氯气点燃,反应方程式为H2 +Cl2 2HCl(3)③反应为氯气与氯化亚铁的反应,离子反应方程式为2Fe2+ +Cl2=2Fe3+ +2Cl-
2HCl(3)③反应为氯气与氯化亚铁的反应,离子反应方程式为2Fe2+ +Cl2=2Fe3+ +2Cl-
考点:无机推断,铁的化学性质,氯气的化学性质。

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
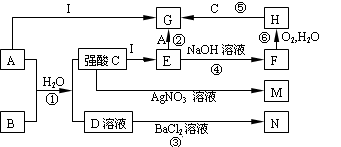

 。按要求回答下列问题:
。按要求回答下列问题:

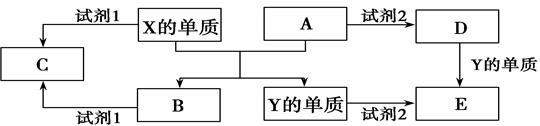
 的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的
的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的