题目内容
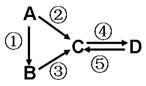
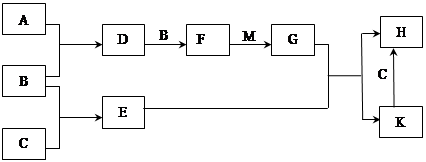
A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图:
填写下列空白:
(1)物质A是____________,物质B是___________,B元素的离子结构示意图为___________。
(2)写出化合物E的电子式:____________,D的饱和溶液滴入沸水中溶液呈红褐色的原因是(用离子方程式表示):_______________________________,D溶液可以用来止血。
(3)工业上把B单质与石灰乳反应可制得漂白粉,漂白粉的有效成份是_______,漂白粉常用于自来水的杀菌消毒,原因是:(用化学方程式和适当的文字说明)______________________。
(4)F中加入NaOH溶液,并在空气中放置,沉淀由白色变为灰绿色最后变成红褐色的化学方程式是_____________________________________。
(1)Fe;Cl2;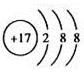
(2)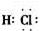 FeCl3+3H2O
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
(3)Ca(ClO)2 ;Ca(ClO)2+CO2+H2O=CaCO3+2HClO;次氯酸钙在自来水中与CO2反应后生产了次氯酸,次氯酸有强氧化性,能起杀菌消毒作用(4)4Fe(OH)2+O2+2H2O═4Fe(OH)3
解析试题分析:A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色则D是氯化铁,A、B都是单质,且A是固体,所以A是铁,B是氯气;B和C反应时可观察到苍白色火焰,其产物极易溶于水得无色溶液E,则C是氢气,E是氯化氢,盐酸和铁反应生成氯化亚铁,则F是氯化亚铁。
(1)由上述分析可知,A为Fe,B为Cl2,Cl-的离子结构示意图为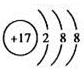 (2)由上述分析知E为HCl,其电子式为
(2)由上述分析知E为HCl,其电子式为 D为FeCl3,在沸水中水解生成胶体,该反应为FeCl3+3H2O
D为FeCl3,在沸水中水解生成胶体,该反应为FeCl3+3H2O Fe(OH)3(胶体)+3HCl(3)B气体制取漂白粉,氯气与石灰乳反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其有效成分为Ca(ClO)2,次氯酸钙在自来水中与CO2反应后生产了次氯酸,次氯酸有强氧化性,能起杀菌消毒作用(4)氯化亚铁和氢氧化钠反应生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定易被氧气氧化生成红褐色氢氧化铁,反应方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3。
Fe(OH)3(胶体)+3HCl(3)B气体制取漂白粉,氯气与石灰乳反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其有效成分为Ca(ClO)2,次氯酸钙在自来水中与CO2反应后生产了次氯酸,次氯酸有强氧化性,能起杀菌消毒作用(4)氯化亚铁和氢氧化钠反应生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定易被氧气氧化生成红褐色氢氧化铁,反应方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3。
考点:无机物的推断

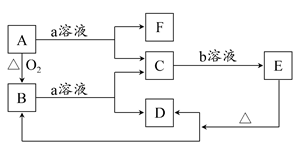
 。按要求回答下列问题:
。按要求回答下列问题: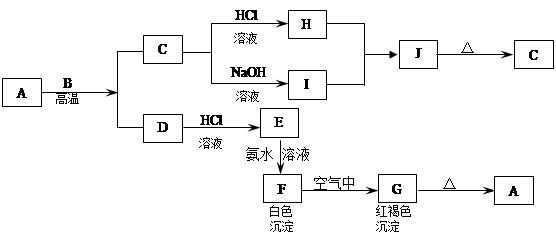

 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式