题目内容
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② | | | |
| | | ⑦ | ⑧ |
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是 ,②元素的氧化物的电子式是 ,②与⑧形成的化合物中存在的化学键是 ,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是 (用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是 (用离子符号填)。
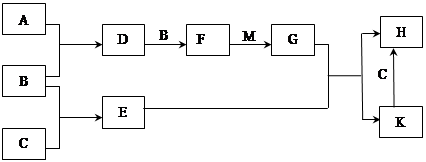
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:
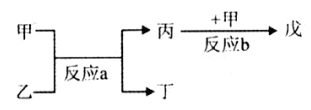
①写出反应a的化学方程式: 。
②写出戊与丁反应的化学方程式: 。
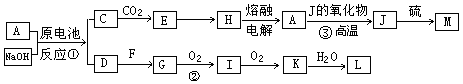
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。
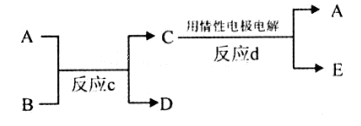
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为: 。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为 。
(1)第三周期第ⅥA;(2分)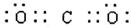 (1分)
(1分)
共价键(1分)H2CO3、H2SO4、HClO4;(1分)S2―>Cl―(1分)
(2)①4NH3+5O2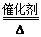 4NO+6H2O(2分)
4NO+6H2O(2分)
②3NO2+H2O=2HNO3+NO(2分)
(3) ①Cu2++2e―=Cu(2分)
②2Al+Fe2O3 2Fe+Al2O3(2分)
2Fe+Al2O3(2分)
解析试题分析:(1)②的原子序数不可能是1,由②在周期表中的位置可知,②处于第二周期,⑦⑧处于第三周期,②与⑦形成的液体化合物是常见的重要溶剂,该化合物为SC2或CCl4,由②⑦⑧的位置可知,②为碳,⑦为硫,⑧为氯,②与⑧形成的液体化合物为CCl4,S原子原子有3个电子层,最外层电子数为6,处于周期表中第三周期第ⅥA族;二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为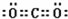 ;CCl4中碳原子与离子之间形成1对共用电子对,为共价键;非金属性C<S<Cl,最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;S2-、Cl-电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,答案为:第三周期第ⅥA族;;共价键;HClO4>H2SO4>H2CO3;S2->Cl-;
;CCl4中碳原子与离子之间形成1对共用电子对,为共价键;非金属性C<S<Cl,最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;S2-、Cl-电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,答案为:第三周期第ⅥA族;;共价键;HClO4>H2SO4>H2CO3;S2->Cl-;
(2)戊为红棕色气体,则戊为NO2,反应b为NO+O2→NO2,由反应a可知,甲与乙反应生成丙,故甲为O2,故丙为NO,反应a为NH3+O2→NO+H2O,乙为NH3,丁为H2O,
①反应a的化学方程式为:4NH3+5O2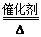 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2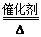 4NO+6H2O;
4NO+6H2O;
②NO2与H2O反应生成HNO3、NO,反应方程式为:3NO2+H2O=2HNO3+NO↑,故答案为:3NO2+H2O=2HNO3+NO↑;
(3)①A是红色金属单质,A为Cu,E是具有黄绿色的气体,则E为Cl2,反应d中阴极发生还原反应,是铜离子放电生成Cu,反应d中阴极电极反应式为:Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
②若反应c是在高温下进行的,物质C是一种两性化合物,为Al2O3,其中B是暗红色固体,为Fe2O3,反应c为铝热反应,A为Al、D为Fe、E为O2,反应c的方程式为:Fe2O3+2Al 2Fe+Al2O3,故答案为:Fe2O3+2Al
2Fe+Al2O3,故答案为:Fe2O3+2Al 2Fe+Al2O3.
2Fe+Al2O3.
考点:元素周期律和元素周期表的综合应用;无机物的推断

下列陈述和判正确、并且有因果关系的是
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液肯定含有SO42- |
| C | 在金属活动顺序表中,金属活动顺序:Fe>H>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,汞和银只需加热,而铁和铜必须用还原剂 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | 蛋白质和淀粉都是高分子化合物 | 蛋白质和淀粉水解最终产物均是葡萄糖 |
| B | 汽油和植物油都属于烃 | 汽油和植物油都可以燃烧 |
| C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
| D | 铝具有还原性 | 铝粉和氧化铁粉末可发生铝热反应 |
 的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的
的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的