题目内容
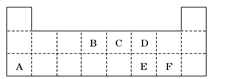
下表是元素周期表的一部分,A、B、C、D、E、X是下表中给出元素组成的常见单质或化合物。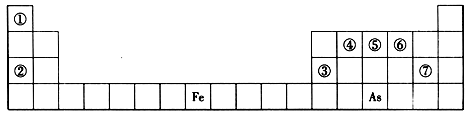
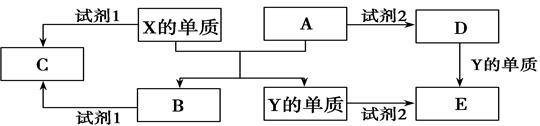
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)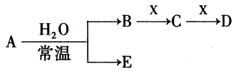
(1)若E为单质气体,D为白色沉淀,A的化学式可能是 , C与X反应的离子方程式为 。
(2)若E为氧化物,则A与水反应的化学方程式为 。
①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为 ,表示X呈碱性的离子方程式为 。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为 。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式 。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为 。
(1)Na(NaH Na2O2) Al3++3AlO2-+6H2O=4Al(OH)3↓
(2)3NO2+H2O=2HNO3+NO
①O=C=O CO32?+H2O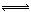 HCO3?+OH?
HCO3?+OH?
②Fe+4H++NO3?=Fe3++NO↑+2H2O
(3)CO+H2O 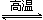 CO2+H2 50%
CO2+H2 50%
解析试题分析:根据元素在周期表中的位置可判断元素的种类,①为H元素,②为Na元素,③为Al元素,④为C元素,⑤为N元素,⑥为O元素,⑦为Cl元素。
(1)根据表中的元素可知,只有⑤形成的物质与水反应生成氢气,则A可能为Na、Na2O2或NaH;白色沉淀为Al(OH)3, C与X反应的离子反应为3AlO2-+Al3++6H2O═4Al(OH)3↓。
(2)根据表中的元素可知,只有③形成的物质与水反应生成NO气体符合,则A为NO2,A与水反应生成硝酸和一氧化氮,其反应为3NO2+H2O═2HNO3+NO。
①硝酸与碳酸盐反应生成二氧化碳,分子中有6+8×2=22个电子,C为CO2,结构式为:O=C=O;CO32?水解使X溶液显碱性,离子方程式为: CO32?+H2O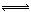 HCO3?+OH?
HCO3?+OH?
②当X为金属时,应为变价金属Fe,X与B的稀溶液反应生成C的离子方程式为:Fe+4H++NO3?=Fe3++NO↑+2H2O。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则A为Na2O2,B为O2,X为C,CO与水蒸气反应生成二氧化碳和氢气,该反应为:CO+H2O 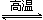 CO2+H2;设开始时CO和H2O的物质的量为1mol,转化的CO为x,则
CO2+H2;设开始时CO和H2O的物质的量为1mol,转化的CO为x,则
CO+H2O 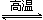 CO2+H2
CO2+H2
起始量(mol) 1 1 0 0
变化量(mol) x x x x
平衡量(mol) 1-x 1-x x x
则x2/(1-x)2=1,可得x=0.5,CO的转化率为0.5mol÷1mol×100%=50%。
考点:本题考查元素周期表和元素周期律、无机物的推断、方程式的书写、转化率的计算。

 通城学典默写能手系列答案
通城学典默写能手系列答案
 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题: 。按要求回答下列问题:
。按要求回答下列问题: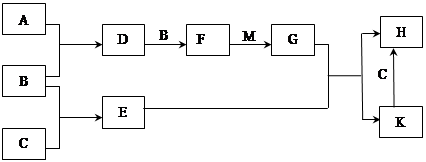

 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式