题目内容
氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)乙的电子式是__________。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是 。
(3)乙在加热条件下与CuO反应可生成Cu和气体单质丙,写出该反应的化学方程式 。
(4)甲与乙之间能发生反应产生H2,判断理由是 。
(1)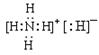
(2)4AlH3+3CO2 3CH4+2Al2O3
3CH4+2Al2O3
(3)2NH4H+5CuO 5Cu+ N2↑+5H2O
5Cu+ N2↑+5H2O
(4)AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。
解析试题分析:“单质气体丙在标准状态下的密度为1.25 g/L”则丙的相对分子质量=1.25×22.4=28,所以丙为N2。化合物乙分解得到H2和N2,由于乙是固体,所以化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物。6.00 g化合物甲分解得到短周期元素的金属单质和6.72L÷22.4L/mol=0.3 molH2。根据质量守恒定律可知,该短周期元素的金属单质的质量为6.00g-0.2mol×2g/mol=5.40g;化合物甲与水反应生成的白色沉淀可溶于NaOH溶液,说明该沉淀可能是Al(OH)3,因此该金属元素是铝,所以可判定化合物甲为AlH3。涉及的反应为:a.甲、乙受热分解:2AlH3 2Al+3H2↑ 2NH4H
2Al+3H2↑ 2NH4H N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO
N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO 5Cu+ N2↑+5H2O。
5Cu+ N2↑+5H2O。
(1)化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物,其电子式为 。
。
(2)AlH3可在加热时将二氧化碳还原为甲烷,则根据原子守恒可知,另外一种生成物应该是氧化铝,所以其化学方程式是4AlH3+3CO2 3CH4+2Al2O3。
3CH4+2Al2O3。
(3)NH4H在加热条件下与CuO反应可生成Cu和气体单质氮气,因此根据原子守恒可知,还有水生成,所以该反应的化学方程式 2NH4H+5CuO 5Cu+ N2↑+5H2O。
5Cu+ N2↑+5H2O。
(4)由于AlH3中氢元素的化合价为-1价,—1价H还原性很强,NH4H中含有+1价的氢元素,具有氧化性,所以二者可发生氧化还原反应产生H2。
考点:考查根据物质的性质及其计算进行推理,以及化学式、电子式、化学方程式的正确书写

下列陈述和判正确、并且有因果关系的是
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液肯定含有SO42- |
| C | 在金属活动顺序表中,金属活动顺序:Fe>H>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,汞和银只需加热,而铁和铜必须用还原剂 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
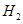 的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的
的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的