题目内容
【题目】下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
【答案】B
【解析】
A. CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,故A错误;B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键,如H2中只存在σ键,N2中存在σ键和π键,故B正确;C.氢原子的电子云图中的小黑点表示电子在核外空间出现机会的多少,而不表示具体的电子运动轨迹,故C错误;D.HCN中C原子的价层电子对数=2+![]() (4-1×3-1×1)=2,采用sp杂化;SiF4中Si的价层电子对数=4+
(4-1×3-1×1)=2,采用sp杂化;SiF4中Si的价层电子对数=4+![]() (4-1×4)=4,SO32-中S的价层电子对数=3+
(4-1×4)=4,SO32-中S的价层电子对数=3+![]() (6+2-2×3)=4,所以中心原子均为sp3杂化,故D错误;故选B。
(6+2-2×3)=4,所以中心原子均为sp3杂化,故D错误;故选B。

 阅读快车系列答案
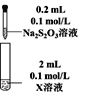
阅读快车系列答案【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。

(1)b中反应的离子方程式为____,c中试剂为_____。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____。
(3)实验中要控制SO2生成速率,可以采取的措施有______(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是____。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:_____。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+___=Ag2S+___
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和___有关(写出两条)。