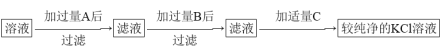
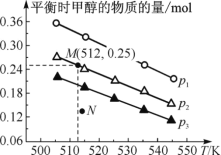
题目内容
【题目】铬及其化合物在工农业生产中具有广泛应用,请回答下列问题:
(1)基态铬原子的核外电子排布式为_____________。
(2)Cr3+能形成配离子[Cr(H2O)(H2NCH2CH2NH2)]3+,在配体H2NCH2CH2NH2 中采用 sp3杂化的原子有_____。
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与 CS2 等互溶.则固态 CrO2Cl2属于________晶体。已知 NO2+与 CS2 互为等电子体,则 1molNO2+中含有π键数目为 ____________
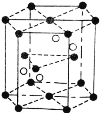
(4)Cr2O3 晶胞结构如图所示,已知 Cr2O3 的摩尔质量为 M g/mol,晶体的密度为ρ g·cm-3 ,晶胞体积为 V cm3. 晶胞结构示意图中的小黑球代表_____(填“铬离子”或“氧离子”),阿伏加德罗常数NA=_________mol-1(用含 M, V, ρ的代数式表示 )。
【答案】[Ar]3d54s1 C、N 分子 2NA 氧离子 ![]()
【解析】
(1)Cr为24号元素,其原子核外有24个电子,根据构造原理书写基态铬原子的核外电子排布式;
(2)在配体H2NCH2CH2NH2中采用sp3杂化的原子价层电子对个数是4;
(3)分子晶体熔沸点较低;NO2+与CS2互为等电子体,等电子体结构相似,二硫化碳分子中含有2个π键,则1个NO2+中含有π键数目为2;
(4)该晶胞中黑色球个数=12×![]() +2×
+2×![]() +3=6、白色球个数为4,则黑色球、白色球个数之比=6:4=3:2,其化学式为Cr2O3,据此判断黑色球代表离子;根据晶体密度ρ=
+3=6、白色球个数为4,则黑色球、白色球个数之比=6:4=3:2,其化学式为Cr2O3,据此判断黑色球代表离子;根据晶体密度ρ=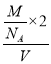 计算NA。
计算NA。
(1)Cr为24号元素,其原子核外有24个电子,根据构造原理书写基态铬原子的核外电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1;
(2)在配体H2NCH2CH2NH2中采用sp3杂化的原子价层电子对个数是4,C、D原子价层电子对个数都是4,所以采用sp3杂化的原子有C、N;
(3)分子晶体熔沸点较低,该物质熔沸点较低,为分子晶体;NO2+与CS2互为等电子体,等电子体结构相似,二硫化碳分子中含有2个π键,则1个NO2+中含有π键数目为2,所以1molNO2+中含有π键数目为2NA;
(4)该晶胞中黑色球个数=12×![]() +2×
+2×![]() +3=6、白色球个数为4,则黑色球、白色球个数之比=6:4=3:2,其化学式为Cr2O3,据此判断黑色球代表离子为氧离子;根据晶体密度ρ=
+3=6、白色球个数为4,则黑色球、白色球个数之比=6:4=3:2,其化学式为Cr2O3,据此判断黑色球代表离子为氧离子;根据晶体密度ρ=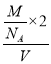 得NA=
得NA=![]() /mol。
/mol。

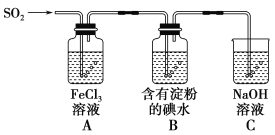
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4