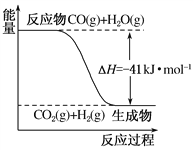
题目内容
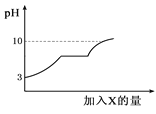
【题目】现有盐酸和氯化钙的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如右图所示,则X是( )
A. 浓硫酸 B. 澄清石灰水
C. 烧碱溶液 D. 纯碱溶液
【答案】D
【解析】
由于随着X的加入溶液由酸性逐渐的变为中性又变为碱性,因此X应是一种碱性物质,首先排除A,再就是图象的中间一段溶液的pH值没有发生变化,说明X也能与氯化钙发生反应,当把氯化钙也消耗完以后,再加X就会导致溶液变为碱性,据此分析解答。
A项,加入浓硫酸,溶液的酸性增强,pH减小,pH不可能大于7,故A项错误;
B项,澄清石灰水即氢氧化钙溶液,呈碱性;若加入澄清石灰水,氢氧化钙与盐酸反应pH增大,但与氯化钙不反应,所以图像应该是上升的曲线,没有一段直线,故B项错误;
C项,氢氧化钠与盐酸发生中和,pH增大,pH到7后说明盐酸已反应完,由于氢氧化钠与氯化钙不反应,继续加入氢氧化钠,溶液的pH继续增大,图像应该是上升的曲线,没有一段直线,故C项错误;
D项,加入纯碱(即碳酸钠)后,碳酸钠与盐酸发生反应,pH增大,pH到7后说明盐酸已反应完,碳酸钠与氯化钙反应生成氯化钠和碳酸钙沉淀,pH值不变,氯化钙反应完后碳酸钠过量,由于碳酸钠显碱性,pH增大,与图像一致,故D项正确;
正确选项D。

 名校课堂系列答案
名校课堂系列答案【题目】卤族元素的单质能与H2反应,反应情况如下表所示:
F2 | 在暗处能剧烈化合并发生爆炸,生成的氟化氢很稳定 |
Cl2 | 光照或点燃发生反应,生成的氯化氢较稳定 |
Br2 | 加热至一定温度才能反应,生成的溴化氢不如氯化氢稳定 |
I2 | 不断加热才能缓慢反应,同一条件下,生成的HI会分解 |
(1)卤族元素位于周期表中的_________族。
(2)用电子式表示HCl的形成过程________。
(3)依据上表,可以推测出:随着核电荷数的增加,________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)I2与H2反应的化学方程式是________。
(5)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。BrCl和FeCl2水溶液发生反应的化学方程式为________。