题目内容
【题目】【化学——选修3:物质结构与性质】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式 , 。
(2)铜元素基态原子的电子排布式为 ,铜单质晶体中的原子堆积模型属于 堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是 (填元素符号),第一电离能最大的是 (填元素符号)。该晶体中的阴离子的立体构型是 ,阴离子的中心原子的杂化方式为 。
(4)氨的沸点 (填“高于”或“低于”)膦(PH3),原因是 。

(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是 。若该晶体的密度为ρg·cm-3,以NA表示阿伏加德罗常数,则该晶胞的边长为a= nm。
【答案】(1)Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4 NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O(2分)
(2)1s22s22p63s23p63d104s1或[Ar] 3d104s1(1分) 面心立方最密堆积(1分)
(3)O(1分) N(1分) 正四面体(1分) sp3(1分)
(4)高于(1分) 因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点(1分)(5)CuCl(1分) 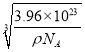 (2分)
(2分)
【解析】
试题分析:(1)根据实验过程和实验现象可知实验前两步反应的离子方程式分别为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4 NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(2)铜元素的原子序数是29,基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar] 3d104s1,铜单质晶体中的原子堆积模型属于面心立方最密堆积堆积。
(3)非金属性越强,电负性越大,则在上述深蓝色晶体所含的非金属元素中,电负性最大的是O,氮元素的2p轨道电子处于半充满状态,稳定性强,则第一电离能最大的是N。该晶体中的阴离子是氯酸根离子,中心原子S原子的价层电子对数是4,且不存在孤对电子,所以其立体构型是正四面体,阴离子的中心原子的杂化方式为 sp3。
(4)因氨分子间存在氢键,膦分子间不存在氢键而只存在范德华力,故氨的沸点高于膦的沸点。
(5)晶胞中氯原子的个数是4个,铜原子的个数是8×1/8+6×1/2=4,所以化学式为CuCl。根据m=Vρ可知a3ρ=![]() ,解得a=
,解得a=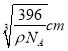 =
=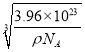 nm。
nm。

