题目内容
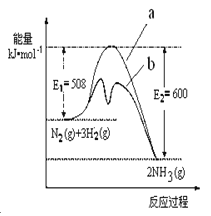
【题目】2 molA与2 molB混合于2 L的密闭容器中,发生反应:2A(g)+3B(g)![]() 2C(g)+zD(g),
2C(g)+zD(g),
若2 s后反应达到平衡,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,计算:
(1)用C表示的反应速率v(C)= mol·L-1·s-1
(2)z=
(3)B的转化率为
(4)C平衡时的物质的量为 mol
【答案】(1)0.25 (2)2 (3)75% (4)1
【解析】
试题分析:若2s后,A的转化率为50%,则A转化的物质的量为2mol×50%=1mol,则
2A(g)+3B(g)![]() 2C(g)+zD(g)
2C(g)+zD(g)
开始 2 2 0 0
转化 1 1.5 1 0.5z
2s后 1 0.5 1 0.5z
v(D)=0.25molL-1s-1,即![]() =0.25molL-1s-1,解得z=2,
=0.25molL-1s-1,解得z=2,
(1)化学反应速率之比等于化学计量数之比,v(C)=v(D)=0.25molL-1s-1;
(2)由上述计算可知,z=2;
(3)B的转化率为![]() ×100%=75%;
×100%=75%;
(4)C平衡时的物质的量为1mol。

【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中不正确的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)

选项 | 预测物质的化学式 | 预测所需指示剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,则原溶液是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A. A B. B C. C D. D