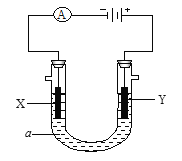
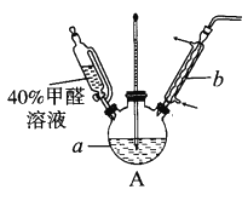
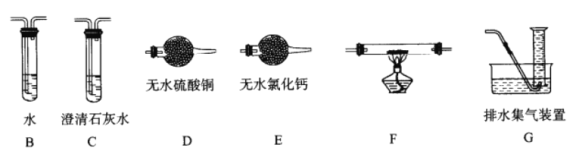
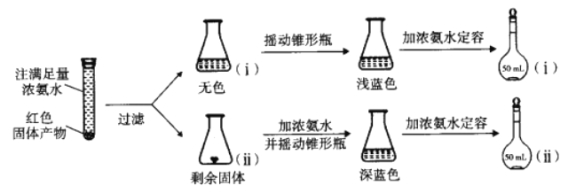
题目内容
【题目】已知25℃时部分弱电解质的电离平衡常数数据如下表:
化学式 | CH3COOH | H2CO3 | HClO | |
平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1) 物质的量浓度均为0.1mol·L一1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3,pH由小到大的排列顺序是___________ (用字母表示)
(2) 常温下,0.1mol·L—1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_______ (填序号)
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH—) D.c(OH-)/c(H+)
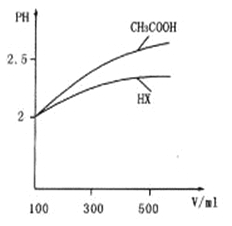
(3) 体积均为l00mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_______ (填“>”、“<”或“=”)CH3COOH的电离平衡常数。
(4) 25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中:
① c(CH3COO—)—c(Na+)=_______ mol·L—1(填精确值)
② c(CH3COO-)/c(CH3COOH)=_______ 。
【答案】(1) a d c b(2) BD(3) 小于 (4) ① 9.9×10-7 ② 18
【解析】
试题解析:(1) 根据平衡常数数据知道,酸性强弱:CH3COOH》H2CO3》HclO;形成盐的酸越弱,水解能力越强,碱性就越强;CH3COONapH最小,Na2CO3的pH最大,NaClO的pH大于NaHCO3;
(1) a d c b;(2) CH3COOH加水稀释,平衡右移,CH3COOH分子数目减少,氢离子、醋酸根离子数目增大,但是离子浓度都减小,但是氢氧根离子浓度增大;A.c(H+)减少; B.c(H+)/c(CH3COOH) 增大,C.c(H+)·c(OH—)不变;D.c(OH-)/c(H+)增大;(2) BD;(3)加水稀释,醋酸的pH变化幅度大于HX,所以酸性,醋酸大于HX,温度一样的情况,HX的电离平衡常数<CH3COOH的电离平衡常数。(4) 在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,醋酸电离过程大于醋酸钠的水解过程;电荷守恒:C(Na+)+C(H+)=C(CH3COO-)+C(OH-);S所以:C(CH3COO-)- C(Na+)= C(H+)- C(OH-)=10-6-106-14=10-6-10-8=9.9×10-7 ② c(CH3COO-)×C(H+)/ c(CH3COOH)×C(H+)=Ka/ C(H+)=1.8×10-5/10-6=18;

【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅧA | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素②的名称是______,元素③的最高价氧化物对于水合物与它的气态氢化物形成的化合物的化学式是________(写化学式)。
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:______________________________(写氢化物的化学式)。
(3)元素⑦的原子结构示意图是____________。
(4)写出实验室制取③的氢化物的化学反应方程式_______________________ 。
(5)用电子式表示①与⑨反应得到的化合物的形成过程_________________________。
(6)⑤和④形成的化合物既含离子键又含共价键的化合物是_________ 。
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:
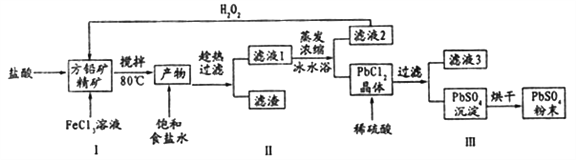
已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。