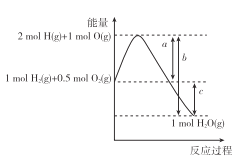
题目内容
【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中不正确的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)

选项 | 预测物质的化学式 | 预测所需指示剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,则原溶液是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A. A B. B C. C D. D
【答案】B
【解析】A.取少量该溶液于试管中,滴入稀盐酸,盐酸可排除其它离子的干扰,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,沉淀为硫酸钡,则原溶液是Na2SO4溶液,故A正确;B.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫,则溶液可能为Na2CO3溶液,故B错误;C.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫,所以则原溶液是Na2SO3溶液,故C正确;D.取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,硅酸不溶于盐酸,则原溶液是Na2SiO3溶液,故D正确;故选B。

【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅧA | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素②的名称是______,元素③的最高价氧化物对于水合物与它的气态氢化物形成的化合物的化学式是________(写化学式)。
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:______________________________(写氢化物的化学式)。
(3)元素⑦的原子结构示意图是____________。
(4)写出实验室制取③的氢化物的化学反应方程式_______________________ 。
(5)用电子式表示①与⑨反应得到的化合物的形成过程_________________________。
(6)⑤和④形成的化合物既含离子键又含共价键的化合物是_________ 。
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:
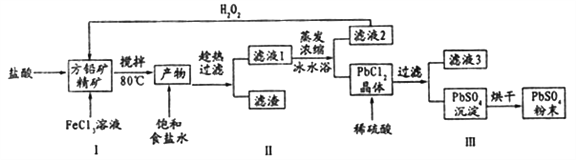
已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。