题目内容
11.某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度.实验步骤:①配制500mL浓度约为0.1mol•L-1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度.(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤可行(填“可行”或“不可行”).
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期小(填“小”或“大”),这是不能直接配制其标准溶液的原因.
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为1 mol•L-1,滴定前将白醋稀释10(填“10”或“100”)倍.(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、容量瓶.
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至溶液变成浅红色且30秒内不褪色即为终点.
重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol•L-1).
(6)原白醋中醋酸的物质的量浓度=$\frac{CV}{2}$mol•L-1.
分析 (1)根据配制的是浓度约为0.1mol•L-1的NaOH溶液来判断;
(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,来分析浓度;
(3)根据醋酸含量约为6g/100mL,计算出醋酸的物质的量,然后根据c=$\frac{n}{V}$来计算;酸碱中和滴定中待测液的浓度要为0.1mol/L左右;
(4)根据稀释醋酸的操作来分析需要的仪器;
(5)根据加入的指示剂是酚酞来分析滴定终点;
(6)根据达滴定终点时,n(CH3COOH)=n(NaOH)来计算.
解答 解:(1)由于配制的是浓度约为0.1mol•L-1的NaOH溶液,是比较粗略的配制,故该配制步骤是可行的,故答案为:可行;
(2)NaOH在空气中极易吸水,导致NaOH的真实的质量偏小,则配制出的溶液的浓度偏小,故答案为:小;
(3)根据醋酸含量约为6g/100mL,则醋酸的物质的量n=$\frac{m}{M}$=$\frac{6g}{60g/mol}$=0.1mol,醋酸的物质的量浓度c=$\frac{n}{V}$=$\frac{0.1mol}{0.1L}$=1mol/L;酸碱中和滴定中待测液的浓度要为0.1mol/L左右,故滴定前要将醋酸溶液稀释10倍,故答案为:1;10;
(4)稀释醋酸的操作需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、容量瓶,故答案为:容量瓶;
(5)由于是用碱滴定酸,指示剂是酚酞,故当溶液变成浅红色且30秒内不褪色时达到滴定终点,故答案为:溶液变成浅红色且30秒内不褪色;
(6)设原白醋中醋酸的物质的量浓度为Xmol/L,根据达滴定终点时,n(CH3COOH)=n(NaOH),可有$\frac{xmol/L}{10}$×0.02L=c mol•L-1×Vml×10-3,解得x=$\frac{CV}{2}$mol/L,
故答案为:$\frac{CV}{2}$.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有三种同分异构体 | |
| C. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 | |
| D. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 |
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA | |
| C. | 标准状况下,11.2L苯中含有的碳碳双键数为1.5NA | |
| D. | 5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3
④2S(g)═S2(g)△H4
则△H4的正确表达式为$\frac{2}{3}$(△H1+△H2-3△H3).
(2)某可逆反应:X(g)+3Y(g)?2Z(g)平衡常数与温度关系如表所示:
| 温度/℃ | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |
②为了增大X的转化率和反应速率,宜采用的措施是B.
A.升高温度 B.增大压强 C.加催化剂 D.分离Z
③在2L密闭容器中充入Z气体,在一定条件下进行反应.下列图1象不能表明该反应达到平衡状态的是A.
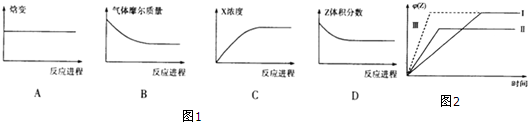
④440℃时,在2L密闭容器中,开始充入1mol X气体和3mol Y气体进行反应.在某时刻测得c(X)=0.45mol/L,此时,反应是否达到平衡状态否(填“是”或“否”),简述理由:此时浓度商Q=$\frac{{c}^{2}(Z)}{c(X){c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.45×1.3{5}^{3}}$=0.0090<K,平衡正向进行.
⑤在某容积固定的容器中进行上述反应,当X、Y起始物质的量一定时,仅改变一个外界条件对Z体积分数的影响如图2所示(曲线I为标准):
ⅰ曲线Ⅱ改变的条件是升温.
ⅱ曲线Ⅲ改变的条件是加合适的催化剂.
| A. | 打开盛装NO的集气瓶;冷却NO2气体 | |
| B. | 用冰水混合物冷却SO3气体;加热氯化铵晶体 | |
| C. | 木炭吸附NO2气体;将氯气通入品红溶液中 | |
| D. | 向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
| A. | 它处在元素周期表中第二周期ⅤA族 | |
| B. | 它的最高正价为+5,负价为-3 | |
| C. | 它的最高价氧化物对应水化物是一元强酸 | |
| D. | 它的非金属性比磷弱比氧强 |
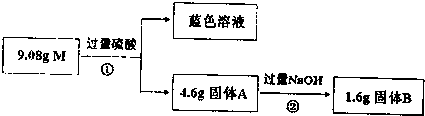
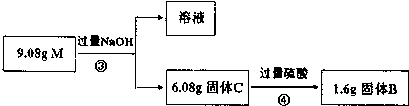
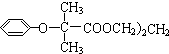
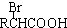 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$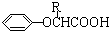
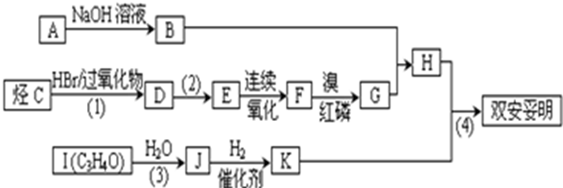

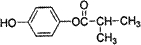 .
.