题目内容
16.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA | |
| C. | 标准状况下,11.2L苯中含有的碳碳双键数为1.5NA | |
| D. | 5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
分析 A、该甲基中含有8个中子,17g该甲基的物质的量为1mol,含有8mol中子;
B、因为乙烯和丙烯的实验式为CH2,可以将混合气体转换为单一的气体(CH2)n,然后计算;
C、标况下,苯为液体,且苯不是单双键交替结构;
D、先判断过量情况,然后根据不足量计算出转移的电子数
解答 解:A、常温常压下,17g甲基(-14CH3)的物质的量为1mol,1mol该甲基中含有8mol中子,所含的中子数为8NA,故A错误;
B、因为乙烯和丙烯的实验式为CH2,可以将混合气体转换为单一的气体(CH2)n,n(C)=$\frac{42g}{14ng/mol}$×n=3mol,混合气体中含有的碳原子数为3NA,故B正确.
C、标况下,苯为液体,且苯不是单双键交替结构,即苯中无碳碳双键,故C错误;
D、5.6g铁的物质的量为0.1mol,0.1mol氯气完全反应消耗0.15mol氯气,氯气不足,反应转移的电子的物质的量为0.2mol,转移的电子数为0.2NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
13.下列反应过程能量的变化符合图示的是( )
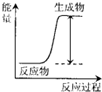

| A. | H+H→H-H | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O | |
| D. | H2SO4+2KOH═K2SO4+2H2O |
4.CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下:
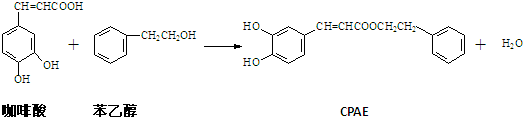
下列分析正确的是( )

下列分析正确的是( )
| A. | 1molCPAE与NaOH溶液,浓溴水和氢气反应时最多消耗的NaOH、Br2和H2的物质的量分别是3mol、4mol和7mol | |
| B. | 咖啡酸分子中至少有9个碳原子共平面 | |
| C. | 咖啡酸、苯乙醇及CPAE都能发生取代,加成和消去反应 | |
| D. | 用FeCl3溶液可以检测上述反应中是否有CPAE生成 |
8.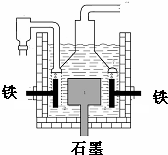 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-=Na | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:1 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
5.下列溶液中微粒的物质的量浓度关系或溶液的物质的量浓度关系正确的是( )
| A. | 0.1mol/L的NaHSO3溶液中:c(OH-)-c(H+)=c(SO32-)-c(H2SO3) | |
| B. | 1L 0.1mol/L的(NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| D. | 向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至中性时:c(SO42-)>c(Na+)=c(NH4+)>c(OH-)=c(H+) |
6.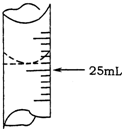 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为23.80mL;
(2)乙学生做了三组平行实验,数据记录如下:
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为0.1044mol•L-1(小数点后保留四位);
(3)下列哪些操作会使测定结果偏高AC(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为23.80mL;
(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
(3)下列哪些操作会使测定结果偏高AC(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
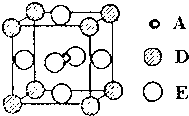 A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2.
A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2. 绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题:
绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题: