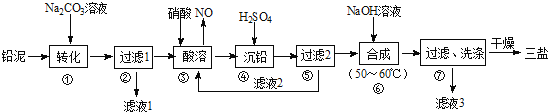
题目内容
【题目】苯乙烯是重要的化工原料,可由乙烯、乙炔为原料合成。反应过程如下所示:
乙炔聚合:3C2 H2 (g)![]() C6H6 (g) H1
C6H6 (g) H1
合成乙苯:C6H6(g)+C2H4(g)![]() C6H5CH2CH3(g) H2
C6H5CH2CH3(g) H2
乙苯脱氢:C6H5CH2CH3(g)![]() C6H5CH=CH2 (g)+H2 (g) △H3
C6H5CH=CH2 (g)+H2 (g) △H3
(1)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0 L恒容密闭容器中充入0.10mol C6H5CH2CH3 (g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①计算该温度下的平衡常数K= ______(结果保留至小数点后两位)。
②下列不能说明该温度下反应达到平衡状态的是_____(填字母代号)。
a.v(C6H5CH2CH3)=v(H2) b.苯乙烯的体积分数不变
c.平衡常数K保持不变 d.混合气体的平均相对分子质量不变
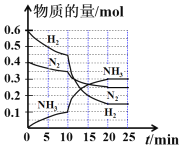
(2)向体积为3.0 L的恒容密闭容器中充入0. 20 mol C6H5CH2CH3(g),当乙苯脱氢反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。

①该反应的H3______0(填“大于”“等于”或“小于”)。
②该平衡体系在600℃时,乙苯的物质的量分数为50%,则氢气的物质的量分数为_____。若在此温度下加入水蒸气作稀释剂,则乙苯的平衡转化率将如何变化并简述理由__________。
(3)苯乙烯能与酸性KMnO4溶液混合反应生成苯甲酸(C6H5COOH)。室温下,向饱和苯甲酸溶液中加入碳酸氢钠固体使溶液显中性,则溶液中c(C6H5COOH):c(C6H5COO-)=___________。(已知:苯甲酸的Ka=6.4×l0-5;碳酸的Kal=4.2×l0-7,Ka2=5.6×l0-ll)
【答案】0.75 mol/L ac大于25% 不变,因为乙苯、苯乙烯、氢气的浓度没有改变,平衡不移动1. 5625×10-3(或![]() )
)
【解析】
(1)①相同条件下压强之比等于物质的量之比,反应前后物质的量的增大是反应的乙苯的物质的量,结合转化率概念计算得到;依据化学平衡三段式列式计算平衡浓度算出平衡常数;②根据化学平衡的特征“等”、“定”及由此衍生的一些量来判断平衡;(2)①根据影响化学反应速率和平衡移动的因素来回答;②根据体积分数的定义式进行计算;若在此温度下加入水蒸气作稀释剂,对浓度没有影响。(3)根据电离常数定义式去解Ka=c(H+)c(C6H5COO-)/c(C6H5COOH)。
(1)①恒温恒容条件下,压强之比等于物质的量之比,所以由总压强p和起始压强p0计算反应物乙苯的转化率α(乙苯)的表达式α(乙苯)=(P-P0)/P 0×100%=(P/P0-1)×100%,平衡时乙苯的转化率=(9.53-4.91)/4.91×100%=94.1%,
依据化学平衡三段式 列式得到;
C6H5CH2CH3(g)![]() C6H5CH=CH2 (g)+H2 (g)
C6H5CH=CH2 (g)+H2 (g)
起始量(mol·L-1) 0.050 0 0
变化量(mol·L-1) 0.050×94.1% 0.050×94.1% 0.050×94.1%
平衡量(mol·L-1)0.050(1-94.1%) 0.050×94.1% 0.050×94.1%
K=c(B)·c(C)/c(A)=0.9412×0.0502/0.05×(1-94.1%)=0.75mol·L-1
②a.v(C6H5CH2CH3)=v(H2),没有注明正速率还是逆速率,故错误;b.苯乙烯的体积分数不变,说明各组分的浓度不随着时间的改变而改变,达到了平衡,故正确;c.温度不变,平衡常数K保持不变,故错误;d.混合气体的平均相对分子质量不变,混合气体的质量不变,物质的量总量不变,达到了平衡,故正确;故选ac。(2)①由图,升高温度,氢气体积分数增加,平衡正向移动,该反应的H3大于0②该平衡体系在600℃时,乙苯的物质的量分数为50%,![]() ,
,![]() =1/3,则氢气的物质的量分数为
=1/3,则氢气的物质的量分数为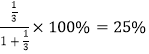 。若在此温度下加入水蒸气作稀释剂,则乙苯的平衡转化率将如何变化并简述理由不变,因为乙苯、苯乙烯、氢气的浓度没有改变,平衡不移动 。(3)室温下,向饱和苯甲酸溶液中加入碳酸氢钠固体使溶液显中性,c(H+)=10-7mol·L-1,c(C6H5COO-)=10-7mol·L-1,Ka=c(H+)c(C6H5COO-)/c(C6H5COOH)则溶液中c(C6H5COOH):c(C6H5COO-)=c(H+)/Ka=10-7/6.4×l0-5=1. 5625×10-3(或
。若在此温度下加入水蒸气作稀释剂,则乙苯的平衡转化率将如何变化并简述理由不变,因为乙苯、苯乙烯、氢气的浓度没有改变,平衡不移动 。(3)室温下,向饱和苯甲酸溶液中加入碳酸氢钠固体使溶液显中性,c(H+)=10-7mol·L-1,c(C6H5COO-)=10-7mol·L-1,Ka=c(H+)c(C6H5COO-)/c(C6H5COOH)则溶液中c(C6H5COOH):c(C6H5COO-)=c(H+)/Ka=10-7/6.4×l0-5=1. 5625×10-3(或![]() )。
)。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 少量的Fe粉中加入足量稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
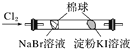
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸先变蓝后变白 | 浓氨水呈碱性且有漂白性 |
D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有强氧化性 |
A. AB. BC. CD. D