题目内容
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 少量的Fe粉中加入足量稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
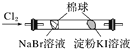
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸先变蓝后变白 | 浓氨水呈碱性且有漂白性 |
D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有强氧化性 |
A. AB. BC. CD. D
【答案】A
【解析】
A.少量的Fe粉中加入稀HNO3,充分反应后,生成硝酸铁,则滴入KSCN溶液变红色,操作、现象和解释均合理,故A正确;
B.氯气可与NaBr、KI均反应,右边棉球变为蓝色,可能是多余的氯气的作用,现象不能说明Br2、I2的氧化性强弱,故B错误;
C.浓氨水电离显碱性,可使红色石蕊试纸变蓝,氨水易挥发,因此一段时间后又褪色,解释或结论不合理,故C错误;
D.浓硝酸加热分解生成二氧化氮,不能说明硝酸具有强氧化性,故D错误;
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】苯乙烯是重要的化工原料,可由乙烯、乙炔为原料合成。反应过程如下所示:
乙炔聚合:3C2 H2 (g)![]() C6H6 (g) H1
C6H6 (g) H1
合成乙苯:C6H6(g)+C2H4(g)![]() C6H5CH2CH3(g) H2
C6H5CH2CH3(g) H2
乙苯脱氢:C6H5CH2CH3(g)![]() C6H5CH=CH2 (g)+H2 (g) △H3
C6H5CH=CH2 (g)+H2 (g) △H3
(1)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0 L恒容密闭容器中充入0.10mol C6H5CH2CH3 (g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①计算该温度下的平衡常数K= ______(结果保留至小数点后两位)。
②下列不能说明该温度下反应达到平衡状态的是_____(填字母代号)。
a.v(C6H5CH2CH3)=v(H2) b.苯乙烯的体积分数不变
c.平衡常数K保持不变 d.混合气体的平均相对分子质量不变
(2)向体积为3.0 L的恒容密闭容器中充入0. 20 mol C6H5CH2CH3(g),当乙苯脱氢反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。

①该反应的H3______0(填“大于”“等于”或“小于”)。
②该平衡体系在600℃时,乙苯的物质的量分数为50%,则氢气的物质的量分数为_____。若在此温度下加入水蒸气作稀释剂,则乙苯的平衡转化率将如何变化并简述理由__________。
(3)苯乙烯能与酸性KMnO4溶液混合反应生成苯甲酸(C6H5COOH)。室温下,向饱和苯甲酸溶液中加入碳酸氢钠固体使溶液显中性,则溶液中c(C6H5COOH):c(C6H5COO-)=___________。(已知:苯甲酸的Ka=6.4×l0-5;碳酸的Kal=4.2×l0-7,Ka2=5.6×l0-ll)