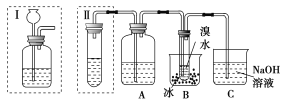
��Ŀ����
����Ŀ��SPC��2Na2CO33H2O2����Na2CO3��H2O2��˫�����ʣ��㷺Ӧ����ӡȾ��ҽҩ������������â����Na2SO410H2O����H2O2��Ϊԭ���Ʊ�SPC�Ĺ����������£�
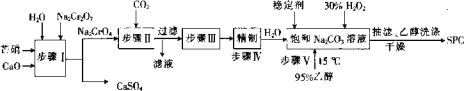
�ش��������⣺
��1������I��_____��������������û����������������ԭ��Ӧ��
��2������II�л�����һ�ֿ���ѭ��ʹ�õ����ʣ������ʵĻ�ѧʽΪ_____��
��3�����������Ҫ���ȣ�������Ӧ�Ļ�ѧ����ʽΪ______��
��4��������У��ϳ�ʱ��ѡ���¶�Ϊ15�棬��Ŀ����_____���ӻ��������ĽǶȿ���ڶ�����д��ڵ�ȱ����_______��
��5��SPC�ı��淽����________��
��6�����������ô������ֽ�ʱ����ˮ����ԭ�ӣ�����ԭ�ӷdz����ã���Ϊ������������0.1600 g��Ʒ�� ����250 mL��ƿ�У�����100 mL 0. 5 molL-1�����ܽ���ȫ��������0.02000molL-1KMnO4����Һ�ζ����ζ����յ�ʱ��Һ��ɫΪ_____���Ұ�����ڲ��ָ�Ϊԭ������ɫ����������ƽ��ʵ�飬����KMnO4��Һ��ƽ�����Ϊ26.56 mL�����⣬�ڲ�����Ʒ������°����������̽��пհ�ʵ�飬����KMnO4��Һ��ƽ�����Ϊ2.24 mL������Ʒ�Ļ���������Ϊ______%��
���𰸡�û�� Na2Cr2O7 2NaHCO3![]() Na2CO3+H2O+CO2�� �¶ȵ���15�棬��Ӧ���������¶ȸ���15�棬�������������ֽ� ���������˸����ƣ�+6�۸��ж�������ɻ�����Ⱦ ���¡��ܹ⡢�ܷⱣ�� dz��ɫ 12.16
Na2CO3+H2O+CO2�� �¶ȵ���15�棬��Ӧ���������¶ȸ���15�棬�������������ֽ� ���������˸����ƣ�+6�۸��ж�������ɻ�����Ⱦ ���¡��ܹ⡢�ܷⱣ�� dz��ɫ 12.16
��������
â����Na2SO410H2O����CaO�м�ˮ���ټ���Na2Cr2O7������CaSO4�������Һ�м���CO2������2CrO42-+2H+![]() Cr2O72-+H2O����Һ��Na2Cr2O7����ѭ��ʹ�ã������к���̼���ơ�̼�����ƣ���̼�����Ƽ��ȷֽ⣺2NaHCO3
Cr2O72-+H2O����Һ��Na2Cr2O7����ѭ��ʹ�ã������к���̼���ơ�̼�����ƣ���̼�����Ƽ��ȷֽ⣺2NaHCO3![]() Na2CO3+H2O+CO2������ˮ�ܽ�õ�����̼���ƣ�����������⣬�����¶�Ϊ15�棬�Ҵ�ϴ�ӣ������SPC��
Na2CO3+H2O+CO2������ˮ�ܽ�õ�����̼���ƣ�����������⣬�����¶�Ϊ15�棬�Ҵ�ϴ�ӣ������SPC��
��1������I�з�Ӧǰ��Ԫ�ػ��ϼ�û�����ı䣬û����������ԭ��Ӧ���ʴ�Ϊ��û�У�
��2����Һ�е���Ҫ�ɷֿ���ѭ��ʹ�ã����ݷ����ɵ���Һ�к��и�Ԫ�أ���2CrO42-+2H+![]() Cr2O72-+H2O�����ѭ������Ϊ��
Cr2O72-+H2O�����ѭ������Ϊ��
Na2Cr2O7���ʴ�Ϊ��Na2Cr2O7��
��3������������ɵ�̼�������ܽ�Ƚ�С�����ȷֽ⣺2NaHCO3![]() Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3
Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����
��4���¶ȵ���15�棬��Ӧ���������¶ȸ���15�棬�������������ֽ⣬���������˸����ƣ�+6�۸��ж�������ɻ�����Ⱦ���ʴ�Ϊ���¶ȵ���15�棬��Ӧ���������¶ȸ���15�棬�������������ֽ⣻���������˸����ƣ�+6�۸��ж�������ɻ�����Ⱦ��
��5������˫��ˮ�ֽ⣬����SPCӦ���¡��ܹ⡢�ܷⱣ�棬�ʴ�Ϊ�����¡��ܹ⡢�ܷⱣ�棻
��6���ζ����յ�ʱ��KMnO4��Һ�Թ�������Һ��dz��ɫ�����ݵ�ʧ�����غ㣬��ƽ���ӷ�Ӧ����ʽ��2MnO4-+5H2O2+6H+=2Mn2++
8H2O+5O2�������εζ�ƽ������KMnO4��Һ26.56mL���հ�ʵ�飬����KMnO4��Һ��ƽ�����Ϊ2.24 mL�����ݹ�ϵʽ��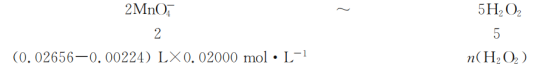
�ã�n(H2O2)=0.001216mol��SPC��Ʒ�Ļ���������Ϊ��![]() ���ʴ�Ϊ��dz��ɫ��12.16��
���ʴ�Ϊ��dz��ɫ��12.16��

 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д� ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�����Ŀ��FeCl2��һ�ֳ��õĻ�ԭ����ýȾ����ij��ѧʵ��С����ʵ���������������ַ������Ʊ���ˮFeCl2���й����ʵ��������£�
C6H5Cl(�ȱ��� | C6H4Cl2(���ȱ��� | FeCl3 | FeCl2 | |
�ܽ��� | ������ˮ�������ڱ����Ҵ� | ������C6H5Cl��C6H4Cl2�������������Ҵ�������ˮ | ||
�۵�/�� | -45 | 53 | ������ | |
�е�/�� | 132 | 173 | ---------------------- | -------------------- |
��1��H2��ԭ��ˮFeCl3��ȡFeCl2���й�װ����ͼ��
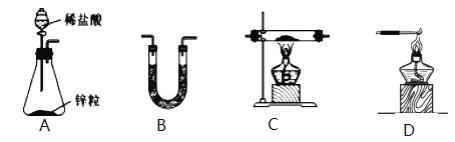
��H2��ԭ��ˮFeCl3��ȡFeCl2�Ļ�ѧ����ʽΪ_____��
�ڰ����������ҵķ�����������������˳��Ϊ_____��������ĸ��װ�ÿɶ��ʹ�ã���B��ʢ�ŵ��Լ���_____��
�۸��Ʊ�װ�õ�ȱ��Ϊ_____��
��2�����÷�Ӧ2FeCl3+C6H5Cl��2FeCl2+C6H4Cl2+HCl������ȡ��ˮFeCl2���ⶨFeCl3��ת���ʡ�����ͼװ�ã���������ƿ�з���32.5g��ˮ�Ȼ����������ȱ������Ʒ�Ӧ�¶���һ����Χ����3h����ȴ�������ᴿ�õ��ֲ�Ʒ��

������a��������_____��
�ڷ�Ӧ��������ȴʵ��װ��A����������ƿ�����ʵ����������ˡ�ϴ�ӡ�����õ��ֲ�Ʒ��ϴ�����õ��Լ�������_____��������Һ��C6H5C1�IJ�����_____��
�۷�Ӧ����ƿ����Һ���250mL����ȡ25.00mL������Һ����0.40mol/L NaOH��Һ�ζ����յ�ʱ����NaOH��ҺΪ19.60mL�����Ȼ�����ת����Ϊ_____��
��Ϊ�˼���ʵ��������ȡ��ˮFeCl2������Ӧ��ȡ�Ĵ�ʩ�У�_____��д��һ�㼴�ɣ���
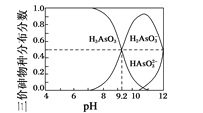
����Ŀ���ظ���س������л��ϳɵ��������ʹ����ȡ��ɺ�����Һ(��Ҫ��Cr3+��Fe3+��K+��SO42-��)�Ʊ�K2Cr2O7��������ͼ��ʾ��

��֪��i.�����������£�H2O2�ܽ�Cr2O72-��ԭΪCr3+��
ii.��ؽ��������γ��������������pH��Χ���£�
�������� | Fe3+ | Cr3+ |
��ʼ������pH | 1.5 | 4.9 |
������ȫ��pH | 2.8 | 6.8 |
�ش��������⣺
(1)�����ٵ���Ҫ�ɷ�Ϊ_________(�ѧʽ)��
(2)"�����������з�����Ӧ�����ӷ���ʽΪ____________��
(3)������"������Ŀ����_________��
(4)���ữ"�����з����ķ�ӦΪ2CrO42- +2H+![]() Cr2O72-+ H2O (K=4.0��1014L3��mol -3)����֪���ữ������Һ(pH=1)��c(Cr2O72- )=6. 4��10-3 mol��L-1������Һ��c(CrO42-)=_______��
Cr2O72-+ H2O (K=4.0��1014L3��mol -3)����֪���ữ������Һ(pH=1)��c(Cr2O72- )=6. 4��10-3 mol��L-1������Һ��c(CrO42-)=_______��
(5)�����������ؽ��Ƹ���ˮ�е�Cr2O72-����ԭ���乤��ԭ����ͼ��ʾ��
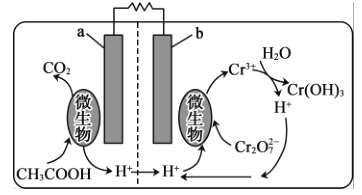
�ڸõ���У�b��______����a���ĵ缫��ӦΪ__________
(6)K2 Cr2O7����Һ�������ڲⶨ������������ƾ���(Na2S2O3��5H2O��M=248 g��mol -1)�Ĵ��ȡ��ⶨ�������£�
i.��Һ���ƣ���ȡ1.2400g������������ƾ�����Ʒ��������в���ȴ������ˮ���ձ����ܽ⣬��ȫ�ܽ��.ȫ��ת����100mL����ƿ��.������ˮ���̶��ߡ�
ii.�ζ���ȡ0.01000 mol. L-1��K2Cr2 O7����Һ20. 00 mL��ϡ�����ữ��������KI��Һ��������Ӧ(Cr2O72-����ԭ��Cr3+ ��I-��������I2)��Ȼ���������������Ʒ��Һ�ζ���������ɫ��������Ӧ��I2+2S2O32 - =S4O62-+2I-�����������Һ��Ϊָʾ���������ζ�������Һ��ɫ��ȥ.��Ϊ�յ㡣ƽ�еζ�3�Σ���Ʒ��Һ��ƽ������Ϊ25.00mL��
��ϡ�����ữ��K2Cr2O7����Һ��KI��Һ��Ӧ�����ӷ���ʽΪ_________
�ڸ�������������ƾ�����Ʒ�Ĵ���Ϊ_______%(����1λС��)��