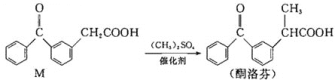
题目内容
【题目】砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
As(s)+![]() O2(g)=
O2(g)=![]() As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=______。
(2)写出砷酸(H3AsO4)的第二步电离方程式_______。
(3)NaH2AsO4溶液呈___(填“酸性”“中性”或“碱性”),试通过计算说明_______。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图所示。
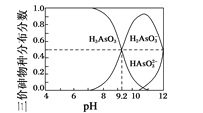
以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______。
(5)某化学兴趣小组同学欲探究可逆反应:AsO33-+I2+2OH-![]() AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
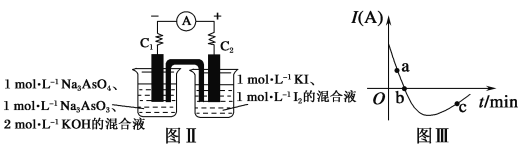
①图Ⅲ中AsO43-的逆反应速率:a__(填“>”“<”或“=”)b。
②写出图Ⅲ中c点对应图Ⅱ装置的正极反应式______。
③能判断该反应达到平衡状态的是__。
a 2v(I-)正=v(AsO33-)逆 b 溶液的pH不再变化
c 电流表示数变为零 d 溶液颜色不再变化
【答案】2ΔH1-3ΔH2-2ΔH3 H2AsO4-![]() H++HAsO42- 酸性 Kh3=
H++HAsO42- 酸性 Kh3=![]() =10-11.75<10-6.77,即Ka2>Kh3,故溶液呈酸性 H3AsO3+OH-=H2AsO3-+H2O < AsO43-+2e-+2H+=AsO33-+H2O bcd
=10-11.75<10-6.77,即Ka2>Kh3,故溶液呈酸性 H3AsO3+OH-=H2AsO3-+H2O < AsO43-+2e-+2H+=AsO33-+H2O bcd
【解析】
(1)将题中已知热化学方程式依次编号为①、②、③,根据盖斯定律,由①×2-②×3-③×2得As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=2ΔH1-3ΔH2-2ΔH3;
(2)砷酸(H3AsO4)为多元弱酸,分步电离,第二步电离方程式为H2AsO4![]() H++HAsO42;
H++HAsO42;
(3)NaH2AsO4溶液Kh3=![]() =10-11.75<10-6.77,即Ka2>Kh3,这说明电离程度大于水解程度,故溶液呈酸性;
=10-11.75<10-6.77,即Ka2>Kh3,这说明电离程度大于水解程度,故溶液呈酸性;
(4)酚酞的变色pH范围为8.2~10.0,当溶液由无色变为浅红色时,根据图中曲线变化知,该过程发生的主要反应为H3AsO3转化为H2AsO3-,离子方程式为H3AsO3+OH-=H2AsO3-+H2O;
(5)①电流由C2流入C1时,C2作正极,发生还原反应,则可逆反应正向进行,随着反应的进行,粒子浓度减小,电流减小,正反应速率减小,逆反应速率增大,故图Ⅲ中AsO43的逆反应速率:a<b;
②图Ⅲ中c点对应的是在加入盐酸后,产生反向电流的情况,此时图Ⅱ装置中C1作正极,正极上AsO43得电子生成AsO33,电极反应式为AsO43+2e-+2H+=AsO33+H2O;
③a项,根据速率关系,v(I-)正=2v(AsO33)逆时,反应处于平衡状态,而2v(I-)正=v(AsO33)逆时反应不处于平衡状态;
b项,溶液的pH不再变化,则氢氧根离子浓度也保持不变,反应处于平衡状态;
c项,电流表示数变为零,则氧化还原反应中不再发生电子转移,反应物的浓度保持不变,反应处于平衡状态;
d项,溶液颜色不再变化,则碘单质的浓度保持不变,反应处于平衡状态,
综上所述选bcd。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案