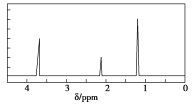
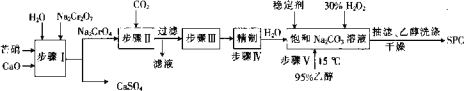
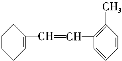
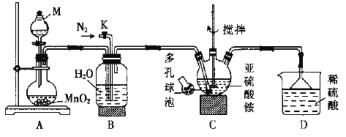
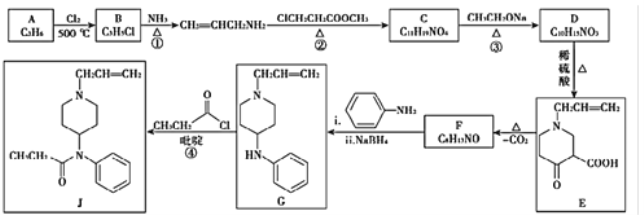
题目内容
【题目】使30 g甲醛完全燃烧后的产物通过足量的Na2O2,Na2O2增重的质量为 ( )
A.10 gB.15 g
C.20 gD.30 g
【答案】D
【解析】
甲醛在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应。发生的反应分别为:HCHO+O2 ![]() CO2+H2O,2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,根据方程式甲醛与二氧化碳的物质的量相等,Na2O2与CO2反应中的质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;Na2O2与H2O反应中的质量增重△m=2H2O-O2=2H2,甲醛(HCHO)改写为CO·H2,故甲醛完全燃烧后产物通过足量的Na2O2,固体增重等于甲醛的质量为30g,故选D。
CO2+H2O,2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,根据方程式甲醛与二氧化碳的物质的量相等,Na2O2与CO2反应中的质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;Na2O2与H2O反应中的质量增重△m=2H2O-O2=2H2,甲醛(HCHO)改写为CO·H2,故甲醛完全燃烧后产物通过足量的Na2O2,固体增重等于甲醛的质量为30g,故选D。

练习册系列答案
相关题目