题目内容
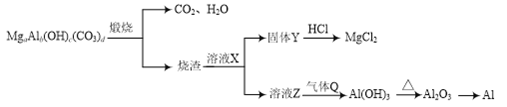
【题目】实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。
(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是___________________________。
(2)装置Ⅰ的主要缺点是______________________________________。
(3)装置Ⅱ的主要缺点是_____________________;
若选用此装置来完成实验,则应采取的措施是___________________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。
【答案】(1)FeCl3溶液 除去H2S、PH3等杂质气体
(2)部分乙炔会从长颈漏斗逸出,造成实验误差,且不易控制加水量
(3)反应产生的泡沫易堵塞导管 在装置的导管口加上一团棉花
(4) ![]() ×100%
×100%
【解析】A瓶中的液体是用来除去混在乙炔中的H2S、PH3,酸性KMnO4溶液会在除去H2S、PH3的同时也将C2H2氧化,故选用FeCl3溶液,装置Ⅰ和Ⅱ均可制乙炔,但装置Ⅰ的主要缺点为部分乙炔气体会从长颈漏斗口逸出,造成实验误差,且长颈漏斗也不易控制加水量。由于CaC2与水剧烈反应产生泡沫,故装置Ⅱ的缺点为泡沫易堵塞导管,可在装置的导管口加上一团棉花。实验时,B处溴水增加质量即为所吸收乙炔的质量,由题意则有:n(CaC2)=n(C2H2)=![]() mol,m(CaC2)=
mol,m(CaC2)=![]() mol×64 g/mol=
mol×64 g/mol=![]() g,CaC2的纯度=
g,CaC2的纯度=![]() ×100%。
×100%。

 口算能手系列答案
口算能手系列答案【题目】硅铁合金广泛应用于冶金工业,可用于铸铁时的脱氧剂、添加剂等,回答下列问题:
(1)基态Fe原子价层电子的电子排布图为________,基态Si原子电子占据最高能级的电子云轮廓图为________形。
(2)绿帘石的组成为![]() ,将其改写成氧化物的形式为_____________.
,将其改写成氧化物的形式为_____________.
(3)![]() 分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
|
|
|
| |
熔点/K | 182.8 | 202.7 | 278.5 | 393.6 |
沸点/K | 177.4 | 330.1 | 408 | 460.6 |
(4)![]() 可与乙二胺(
可与乙二胺(![]() ,简写为en)发生如下反应:
,简写为en)发生如下反应:![]()
![]() 。
。![]() 的中心离子的配位数为________;
的中心离子的配位数为________;![]() 中的配位原子为________。
中的配位原子为________。
(5)在硅酸盐中,![]() 四面体(图
四面体(图
|
|
图a | 图b |