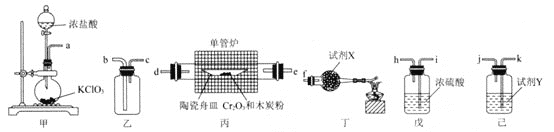
题目内容
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.用惰性电极电解硫酸铜溶液时,若溶液的pH值变为1时,则电极上转移的电子数目为NA
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
【答案】B
【解析】
A.氢气和一氧化碳气体的物质的量为8.96L÷22.4L·mol-1=0.4mol,根据2CO~O2,2H2~O2,可知共消耗O20.2mol,分子数为0.2NA,故A正确;
B.用惰性电极电解硫酸铜溶液时,2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,若溶液的pH值变为1时,没有提供溶液的体积,无法计算生成的硫酸的物质的量,故B错误;
2Cu+O2↑+2H2SO4,若溶液的pH值变为1时,没有提供溶液的体积,无法计算生成的硫酸的物质的量,故B错误;
C. 32.5 g锌的物质的量为0.5mol,完全反应变成锌离子失去1mol电子;与浓硫酸完全反应,无论生成二氧化硫还是生成氢气,每生成1个气体分子达到2个电子,所以转移1mol电子会生成0.5mol气体,生成气体分子数为0.5NA,故C正确;
D. 反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时,参加反应的氢气为0.3mol,转移电子0.6NA,故D正确;
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时,参加反应的氢气为0.3mol,转移电子0.6NA,故D正确;
故选B。

 黄冈冠军课课练系列答案
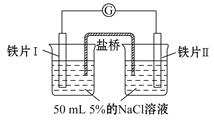
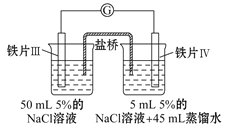
黄冈冠军课课练系列答案【题目】某同学做了如下实验:
装置 |
|
|
现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
下列说法中正确的是
A.加热铁片Ⅰ所在烧杯,电流表指针会发生偏转
B.用KSCN溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极
C.铁片Ⅰ、Ⅲ的腐蚀速率相等
D.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀