题目内容
【题目】某科学家在实验室中将CoCl2·6H2O溶解在煮沸的NH4Cl溶液后,趁热倒入盛有少量活性炭的锥形瓶中,冷却后依次加入浓氨水和H2O2,经过一系列的反应,最终制得了一种橙黄色晶体X,为确定其组成,进行如下实验:
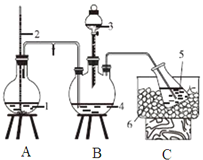
实验一、氨的测定:精确称取w gX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mLc1 mol/L的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mLNaOH溶液。
实验二、氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)
回答下列问题:
(1)图中2是一个长玻璃管,其作用原理是______。
(2)样品中氨的质量分数表达式为______。
(3)测定氨前应进行的操作是______。
(4)测定氯的过程中,使用棕色滴定管的原因是______,滴定终点的现象是______,若溶液中c(Ag+)=2.0×10-5mol/L,c(CrO42-)为______mol/L。(已知:Ksp(Ag2CrO4=1.12×10-12)
(5)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价为______,X的制备过程中温度不能过高的原因是______。
【答案】当A中压力过大时,安全管中液面上升,使A瓶中压力稳定 ![]() ×100% 检查装置气密性 防止硝酸银见光分解 砖红色沉淀不再消失 2.8×10-3 +3 温度越高过氧化氢分解、氨气逸出
×100% 检查装置气密性 防止硝酸银见光分解 砖红色沉淀不再消失 2.8×10-3 +3 温度越高过氧化氢分解、氨气逸出
【解析】
(1)长玻璃管为安全管,通过2中液面调节A中压强;
(2)根据氨气和与氨气反应的盐酸之间的关系式计算氨气的质量,再根据质量分数公式计算氨质量分数;
(3)涉及气体的反应均需检验装置气密性;
(4)考虑硝酸银不稳定,见光易分解;根据滴定原理,AgNO3标准溶液将氯反应完与指示剂作用生成砖红色的沉淀Ag2CrO4;根据离子积常数计算c(CrO42-);
(5)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,则其化学式为[Co(NH3)6]Cl3,根据化合物中各元素化合价的代数和为0计算Co元素化合价;双氧水易分解、气体的溶解度随着温度的升高而降低。
(1)通过2中液面调节A中压强,如果A中压力过大时,安全管中液面上升,使A中压力减小,从而稳定压力;
(2)与氨气反应的n(HCl)=10-3V1 L×c1 mol/L-c2 mol/L×10-3V2 L=10-3(c1V1-c2V2) mol,根据氨气和HCl的关系式知,n(NH3)=n(HCl)= 10-3(c1V1-c2V2) mol,氨的质量分数=![]() ×100%;
×100%;
(3)若装置气密性不好,导致部分氨气泄漏,使氨气质量分数偏低,因此测定氨前应进行的操作是检查装置气密性;
(4)硝酸银不稳定,见光易分解,为防止硝酸银分解,用棕色试剂瓶盛放硝酸银溶液;根据滴定原理,AgNO3标准溶液将Cl-反应完后,会与指示剂作用生成砖红色的Ag2CrO4沉淀,故滴定终点为产生砖红色沉淀不再消失;若溶液中c(Ag+)=2.0×10-5 mol/L,c(CrO42-)= mol/L=2.8×10-3 mol/L;
mol/L=2.8×10-3 mol/L;
(5)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,则其化学式为[Co(NH3)6]Cl3,根据化合物中各元素化合价的代数和为0,可得Co元素化合价为+3价;双氧水易分解、气体的溶解度随着温度的升高而降低,所以X的制备过程中温度不能过高。

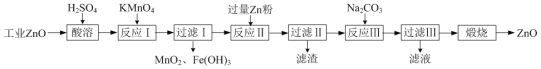
【题目】氧化锌为白色粉末,可用于皮肤病的治疗。提纯工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 8.2 | 8.9 |
(1)写出两种“酸溶”时可以加快反应速率的方法__________、__________。
(2)“反应Ⅰ”溶液的pH≈5,“反应Ⅰ”目的是除去Fe(Ⅱ)、Mn(Ⅱ),写出“反应Ⅰ”中除去Mn(Ⅱ)的离子方程式:__________。
(3)“过滤Ⅱ”所得滤渣的成分为__________。
(4)向“过滤Ⅱ”所得滤液中滴加Na2CO3溶液,所得沉淀为ZnCO3,若反过来滴加,则沉淀中会含有Zn(OH)2。反过来滴加生成Zn(OH)2的原因是__________。
⑸“过滤Ⅲ”所得沉淀需进行洗涤,检查沉淀已经洗涤干净的方法是__________。