题目内容
【题目】无水三氯化铬![]() 为紫色单斜晶体,极易潮解和升华,常用作其他铬盐的合成原料。某课题小组利用
为紫色单斜晶体,极易潮解和升华,常用作其他铬盐的合成原料。某课题小组利用![]() 浅绿色粉末
浅绿色粉末![]() 、木炭粉和
、木炭粉和![]() 制备无水
制备无水![]() 并测定其纯度,制备时用到的实验装置如下。
并测定其纯度,制备时用到的实验装置如下。
请回答下列问题:
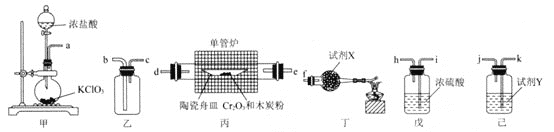
![]() 上述装置的连接顺序为
上述装置的连接顺序为![]() ________
________![]() 填装置接口处的小写字母
填装置接口处的小写字母![]() 。
。
![]() 试剂X、Y可分别选用下列试剂中的________、________
试剂X、Y可分别选用下列试剂中的________、________![]() 填序号
填序号![]() 。装置丁中酒精灯的作用是________。
。装置丁中酒精灯的作用是________。
![]() 溶液
溶液 ![]() 无水
无水![]()
![]() 碱石灰
碱石灰 ![]() 酸性
酸性![]() 溶液
溶液 ![]() 饱和食盐水
饱和食盐水
![]() 装置乙中使用粗导管的原因为________。
装置乙中使用粗导管的原因为________。
![]() 装置丙中发生反应的化学方程式为________。
装置丙中发生反应的化学方程式为________。
![]() 实验结束后,装置乙中的实验现象为________。
实验结束后,装置乙中的实验现象为________。
![]() 测定样品中三氯化铬的含量。
测定样品中三氯化铬的含量。
称取![]() 样品溶于水配制成
样品溶于水配制成![]() 溶液,取
溶液,取![]() 所得溶液于锥形瓶中,加入
所得溶液于锥形瓶中,加入![]() 的
的![]() 溶液,充分反应后,加入指示剂,用
溶液,充分反应后,加入指示剂,用![]() 的
的![]() 标准溶液滴定至终点时,消耗标准溶液的体积为
标准溶液滴定至终点时,消耗标准溶液的体积为![]() 已知:
已知:![]() 、
、![]() 。
。
![]() 该样品中
该样品中![]() 的质量分数为________
的质量分数为________![]() 计算结果精确到
计算结果精确到![]() 。
。
![]() 若滴定至终点时,发现滴定管尖嘴处有气泡,则测定结果________
若滴定至终点时,发现滴定管尖嘴处有气泡,则测定结果________![]() 填“偏高”“偏低”或“无影响”
填“偏高”“偏低”或“无影响”![]() 。
。
【答案】![]()
![]()
![]() 除去尾气中的可燃性气体CO,防止空气污染 防止
除去尾气中的可燃性气体CO,防止空气污染 防止![]() 堵塞导管 Cr2O3+3C+3Cl2
堵塞导管 Cr2O3+3C+3Cl2![]() 2CrCl3+3CO 长导管和广口瓶内壁有紫色固体附着
2CrCl3+3CO 长导管和广口瓶内壁有紫色固体附着 ![]() 偏高
偏高
【解析】
利用甲制备氯气,由于CrCl3极易潮解,因此必须要除去氯气中的杂质,用饱和食盐水除去HCl,用浓硫酸进行干燥,洗气时长进短出,通入丙装置中发生反应制备无水三氯化铬,产品极易升华,得到的为气态的CrCl3,用乙进行收集,最后的尾气吸收,尾气包括了多余的Cl2,用碱石灰吸收,生成的CO,在尾部点燃。
![]() 甲为氯气的发生装置,
甲为氯气的发生装置,![]() 中含有HCl和水蒸气,用饱和食盐水除去HCl,用浓硫酸进行干燥,洗气时长进短出,通入丙装置中发生反应制备无水三氯化铬,产品极易潮解和升华,用乙进行收集,所以连接顺序为:
中含有HCl和水蒸气,用饱和食盐水除去HCl,用浓硫酸进行干燥,洗气时长进短出,通入丙装置中发生反应制备无水三氯化铬,产品极易潮解和升华,用乙进行收集,所以连接顺序为:![]() ;
;
故答案为:![]() ;
;
![]() 未避免外界空气中的水蒸气进入装置导致产品潮解,则在装置丁中应装有碱石灰,试剂Y为饱和食盐水;制备时发生的反应为:Cr2O3+3C+3Cl2
未避免外界空气中的水蒸气进入装置导致产品潮解,则在装置丁中应装有碱石灰,试剂Y为饱和食盐水;制备时发生的反应为:Cr2O3+3C+3Cl2![]() 2CrCl3+3CO,则酒精灯的作用是除去尾气中的可燃性气体CO,防止空气污染;
2CrCl3+3CO,则酒精灯的作用是除去尾气中的可燃性气体CO,防止空气污染;
故答案为:![]() ;
;![]() ;除去尾气中的可燃性气体CO,防止空气污染;
;除去尾气中的可燃性气体CO,防止空气污染;
![]() 装置乙为产品的收集装置,产品凝华会导致堵塞,则使用粗导管的原因为防止
装置乙为产品的收集装置,产品凝华会导致堵塞,则使用粗导管的原因为防止![]() 堵塞导管;
堵塞导管;
故答案为:防止![]() 堵塞导管;
堵塞导管;
![]() 由题意可知,装置丙中发生反应的化学方程式为:Cr2O3+3C+3Cl2
由题意可知,装置丙中发生反应的化学方程式为:Cr2O3+3C+3Cl2![]() 2CrCl3+3CO;
2CrCl3+3CO;
故答案为:Cr2O3+3C+3Cl2![]() 2CrCl3+3CO;
2CrCl3+3CO;
![]() 装置乙为收集装置,则其中现象为:长导管和广口瓶内壁有紫色固体附着;
装置乙为收集装置,则其中现象为:长导管和广口瓶内壁有紫色固体附着;
故答案为:长导管和广口瓶内壁有紫色固体附着;
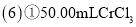 溶液中
溶液中![]() 的物质的量为:
的物质的量为:![]() ,则该样品中
,则该样品中![]() 的质量分数为:
的质量分数为: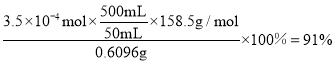 ;
;
故答案为:![]() ;
;
![]() 若滴定至终点时,发现滴定管尖嘴处有气泡,则消耗的标准
若滴定至终点时,发现滴定管尖嘴处有气泡,则消耗的标准![]() 溶液体积偏小,则与
溶液体积偏小,则与![]() 反应的EDTA量偏高,测定结果偏高;
反应的EDTA量偏高,测定结果偏高;
故答案为:偏高。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】下列事实不能用勒夏特列原理解释的是
A.打开可乐瓶有大量泡沫冒出
B.新制的氯水在光照下颜色变浅
C.用饱和食盐水除去氯气中氯化氢杂质
D.容器中有H2(g)+I2(g)![]() 2HI(g),增大压强颜色变深
2HI(g),增大压强颜色变深
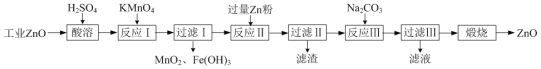
【题目】氧化锌为白色粉末,可用于皮肤病的治疗。提纯工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 8.2 | 8.9 |
(1)写出两种“酸溶”时可以加快反应速率的方法__________、__________。
(2)“反应Ⅰ”溶液的pH≈5,“反应Ⅰ”目的是除去Fe(Ⅱ)、Mn(Ⅱ),写出“反应Ⅰ”中除去Mn(Ⅱ)的离子方程式:__________。
(3)“过滤Ⅱ”所得滤渣的成分为__________。
(4)向“过滤Ⅱ”所得滤液中滴加Na2CO3溶液,所得沉淀为ZnCO3,若反过来滴加,则沉淀中会含有Zn(OH)2。反过来滴加生成Zn(OH)2的原因是__________。
⑸“过滤Ⅲ”所得沉淀需进行洗涤,检查沉淀已经洗涤干净的方法是__________。