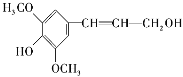
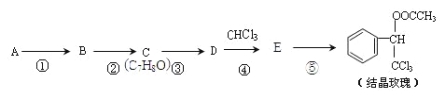
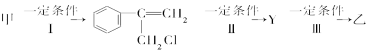题目内容
【题目】氧化铁是重要工业颜料,以废铁屑为原料制备氧化铁的步骤如下:(部分操作和条件略)
步骤1:用碳酸钠溶液洗去铁屑表面的油污。
步骤2:加入稍过量的稀硫酸,保持50~80℃,充分反应后,过滤。
步骤3:将滤液与稍过量的NH4HCO3溶液混合,得到FeCO3的浊液。
步骤4: 、 、 ,得到FeCO3固体。
步骤5:煅烧FeCO3,得到Fe2O3固体。
(1)步骤2中,如何判断反应已经充分? 。
(2)步骤2所得的滤渣中主要含有一种铁的化合物W(Fe3C),经以下处理后,回收利用:W在足量的空气中高温煅烧,生成有磁性的固体X;将X溶于稀硫酸。
①煅烧时1 mol W消耗O2 mol。
②X溶于稀硫酸的离子方程式为 。
(3)步骤3生成FeCO3反应的化学方程式为 。
(4)将步骤4补充完整: 、 、 。
(5)若煅烧时条件控制不当,会使产品中存在杂质FeO。
①若要设计实验检验产品中是否存在FeO,且只能选用两种试剂,这两种试剂是 。
②现煅烧116.0 kg的FeCO3,得到79.2 kg产品,则该产品的纯度为__________。(设产品中只有一种杂质FeO,计算结果保留3位有效数字)
【答案】
(1)溶液中不再产生气泡(或只有极少数气泡);
(2)3; Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O;
(3)FeSO4 + 2NH4HCO3 = FeCO3 ↓+ (NH4)2SO4 + CO2↑ + H2O;
(4)过滤 、洗涤、干燥;
(5)稀硫酸和酸性KMnO4溶液(或稀盐酸和K3[Fe(CN)6]溶液);90.9%。
【解析】
试题分析:(1)废铁屑表面的油污可以与碱发生反应产生可溶性的物质,然后加入稍过量的硫酸,与Na2CO3发生反应,若碳酸钠反应完全,硫酸过量,则加入硫酸时不再反应产生气体;(2)步骤2所得的滤渣中主要含有一种铁的化合物W(Fe3C),经以下处理后,回收利用:W在足量的空气中高温煅烧,生成有磁性的固体X;X是Fe3O4, ① Fe3O4煅烧发生反应产生Fe2O3,Fe3C在空气中煅烧,发生反应产生Fe3O4和CO2;根据质量守恒定律可得反应的方程式:Fe3C+3O2![]() Fe3O4+ CO2,可见煅烧时1 mol W消耗O2的物质的量是3mol。 ② X是Fe3O4,溶于稀硫酸反应产生硫酸铁、硫酸亚铁和水,反应的离子方程式为Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O;(3)步骤3中NH4HCO3与FeSO4溶液发生反应生成FeCO3,该反应的化学方程式为FeSO4 + 2NH4HCO3 = FeCO3 ↓+ (NH4)2SO4 + CO2↑ + H2O;(4)步骤4是从含有FeCO3的悬浊液中分离得到纯净的FeCO3的操作,操作方法是过滤、洗涤、干燥;(5)若煅烧时条件控制不当,会使产品中存在杂质FeO。①若要设计实验检验FeCO3产品中是否存在FeO,可以用稀硫酸溶解样品,然后根据Fe2+的还原性,用标准酸性KMnO4溶液滴定,根据一定量的样品产生的Fe2+的物质的量进行判断;也可以根据FeO与酸反应产生Fe2+,用K3[Fe(CN)6]溶液滴定会产生蓝色沉淀检验;②现煅烧116.0 kg的FeCO3,若是FeCO3完全转化生成Fe2O3,则根据Fe元素守恒, n(FeCO3)=116.0×103g÷116g/mol=1.0×103mol,可得n(Fe2O3)= 1/2n(FeCO3)=500mol,其质量是m(FeCO3)= 500mol×160g/mol=80000g=80.0kg,实际质量是79.2×103g ;根据反应方程式:4FeO+O2
Fe3O4+ CO2,可见煅烧时1 mol W消耗O2的物质的量是3mol。 ② X是Fe3O4,溶于稀硫酸反应产生硫酸铁、硫酸亚铁和水,反应的离子方程式为Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O;(3)步骤3中NH4HCO3与FeSO4溶液发生反应生成FeCO3,该反应的化学方程式为FeSO4 + 2NH4HCO3 = FeCO3 ↓+ (NH4)2SO4 + CO2↑ + H2O;(4)步骤4是从含有FeCO3的悬浊液中分离得到纯净的FeCO3的操作,操作方法是过滤、洗涤、干燥;(5)若煅烧时条件控制不当,会使产品中存在杂质FeO。①若要设计实验检验FeCO3产品中是否存在FeO,可以用稀硫酸溶解样品,然后根据Fe2+的还原性,用标准酸性KMnO4溶液滴定,根据一定量的样品产生的Fe2+的物质的量进行判断;也可以根据FeO与酸反应产生Fe2+,用K3[Fe(CN)6]溶液滴定会产生蓝色沉淀检验;②现煅烧116.0 kg的FeCO3,若是FeCO3完全转化生成Fe2O3,则根据Fe元素守恒, n(FeCO3)=116.0×103g÷116g/mol=1.0×103mol,可得n(Fe2O3)= 1/2n(FeCO3)=500mol,其质量是m(FeCO3)= 500mol×160g/mol=80000g=80.0kg,实际质量是79.2×103g ;根据反应方程式:4FeO+O2![]() 2Fe2O3,可知每含有4×72g=288gFeO,质量减轻32g,现在质量减轻80.0kg -79.2kg=0.8kg=800g,则其中含有FeO的质量是m(FeO0=(288g×800)÷32=7200g=7.2kg,所以79.2×103g÷160g/mol=495mol,含有Fe元素的物质的量是n(Fe)=2 n(Fe2O3)=2×495mol=990mol,所以该产品的纯度为[(79.2 kg-7.2kg)÷79.2kg]×100%=90.9%。
2Fe2O3,可知每含有4×72g=288gFeO,质量减轻32g,现在质量减轻80.0kg -79.2kg=0.8kg=800g,则其中含有FeO的质量是m(FeO0=(288g×800)÷32=7200g=7.2kg,所以79.2×103g÷160g/mol=495mol,含有Fe元素的物质的量是n(Fe)=2 n(Fe2O3)=2×495mol=990mol,所以该产品的纯度为[(79.2 kg-7.2kg)÷79.2kg]×100%=90.9%。

【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。