题目内容
4.某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量,他们设计如图1实验装置,请你参与探究,并回答问题:
(1)装置中的氨水可吸收多余的SO2,发生反应的离子方程式是2NH3•H2O+SO2=2NH4++SO32-+H2O,使用倒立的漏斗能防止倒吸的原因是倒扣的漏斗,椭圆形部分体积较大,具有缓冲作用,能防止倒吸;
(2)装置B用于检验SO2的漂白性,其中所盛试剂为品红溶液,装置D用于检验SO2的氧化性性质;
(3)装置C中发生的现象是深黄色的碘水褪色;
(4)如果用盐酸和硫酸钠反应制取二氧化硫,装置如图2所示,其中a导管的作用是,所用硫酸为70%的浓硫酸,不用稀硫酸的原因是二氧化硫在水中的溶解度比较大,浓硫酸具有吸水性,能促使二氧化硫的生成.
(5)他们拟用以下方法(如图3)测定空气中SO2含量(假设空气中无其他还原性气体).
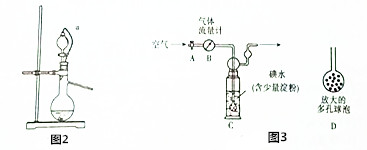
方案Ⅰ:
①洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量偏低(填“偏高”、“偏低”或“无影响”)
方案Ⅱ:

②实验中若通过的空气的体积为33.6L(已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该空气中二氧化碳的含量是否合格(计算过程):不合格.(空气中二氧化碳的体积分数小于0.05%表示合格)
分析 探究SO2的性质实验流程:在装置A1中Cu与浓硫酸共热发生反应反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,生成硫酸铜、二氧化硫气体和水,B、C、D分别检验SO2的漂白性、还原性和氧化性,装置B用品红溶液检验漂白性,在装置C中SO2与碘水发生反应:I2+SO2+2H2O=H2SO4+2HI,检验二氧化硫的还原性,在装置D中发生反应:SO2+2H2S=3S↓+H2O,检验二氧化硫的氧化性,在装置E中用碱性的氨水吸收尾气.
(1)二氧化硫属于酸性氧化物,能和碱溶液反应生成盐和水,易发生倒吸,为了防止倒吸,可以在导管中连接体积较大的容器;
(2)二氧化硫具有漂白性,如果B中品红溶液褪色,证明混合气体中含有二氧化硫气体;装置D用于检验SO2的氧化性;
(3)装置C中SO2与碘水发生反应I2+SO2+2H2O=H2SO4+2HI,碘水褪色;
(4)a导管的作用是平衡分液漏斗和蒸馏烧瓶间的压强,使液体顺利流下,二氧化硫在水中的溶解度比较大,浓硫酸具有酸性和吸水性;
(5)方案Ⅰ:①没有及时关闭活塞A,则通过流量计的气体中的二氧化硫不能全部被吸收;
方案Ⅱ:②生成的沉淀0.233g是硫酸钡,根据n=$\frac{m}{M}$计算硫酸钡的物质的量,根据硫元素守恒,可知n(SO2)=n(H2SO4)=n(BaSO4),根据V=nVm计算二氧化硫的体积,利用体积分数定义计算判断是否合格.
解答 解:(1)二氧化硫有毒不能直接排空,且二氧化硫属于酸性氧化物,能和碱溶液反应生成无毒的盐和水,所以用氨水吸收二氧化硫,离子方程式为:2NH3•H2O+SO2=2NH4++SO32-+H2O,由于二氧化硫气体极易溶于氨水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象,用倒扣的漏斗,椭圆形部分体积较大,具有缓冲作用,能防止倒吸,
故答案为:2NH3•H2O+SO2=2NH4++SO32-+H2O;倒扣的漏斗,椭圆形部分体积较大,具有缓冲作用,能防止倒吸;
(2)装置B用于检验SO2的漂白性,SO2能与某些有色物质如品红结合形成无色的物质,因此SO2有漂白性,在装置B用品红溶液检验,在装置D中发生反应:SO2+2H2S=3S↓+H2O,反应中SO2是氧化剂,表现氧化性,H2S是还原剂,表现还原性,
故答案为:品红溶液;氧化性;
(3)在装置C中SO2与碘水发生反应:SO2+I2+2H2O=SO42-+2I-+4H+,深黄色的碘水褪色,
故答案为:深黄色的碘水褪色;
(4)a导管连接分液漏斗和蒸馏烧瓶,其作用是平衡分液漏斗和蒸馏烧瓶间的压强,使液体顺利流下,常温下,1体积水中溶解40体积的二氧化硫,不用稀硫酸制取二氧化硫的原因是二氧化硫在水中的溶解度比较大,浓硫酸具有吸水性,能促使二氧化硫的生成,
故答案为:平衡分液漏斗和蒸馏烧瓶间的压强,使液体顺利流下;二氧化硫在水中的溶解度比较大,浓硫酸具有吸水性,能促使二氧化硫的生成;
(5)①洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,因此SO2含量偏低,
故答案为:偏低;
方案Ⅱ:②0.233g硫酸钡的物质的量为$\frac{0.233g}{233g/mol}$=0.001mol,根据硫元素守恒,可知n(SO2)=n(H2SO4)=n(BaSO4)=0.01mol,故二氧化硫的体积为0.01mol×22.4L/mol=0.0224L,二氧化硫的体积分数为$\frac{0.0224L}{33.6L}$×100%≈0.067%,大于0.05%不合格,
故答案为:不合格.
点评 本题考查二氧化硫性质及检验、实验装置评价等知识点,为高频考点,二氧化硫具有漂白性、氧化性和还原性,根据试剂性质确定检验目的,注意二氧化硫和碘发生的反应,题目难度中等.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案| A. | H+、SO42、Ba2+、NO3- | B. | Ca2+、H+、NO3、Cl | ||
| C. | Mg2+、K+、NO3-、Cl- | D. | K+、Na+、Mg2+、SO42- |
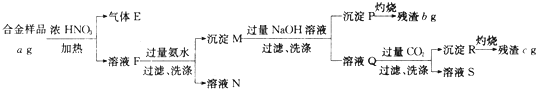
下列相关叙述不正确的是( )
| A. | 气体E呈红棕色,不能直接排放 | |
| B. | 溶液S中所含溶质、沉淀R都可用作药物 | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
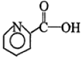
阿司匹林:
 芬必得:
芬必得: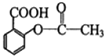
扑热息痛:
 维生素B5:
维生素B5: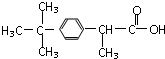
有关这些物质的说法正确的是( )
| A. | 都含有苯环 | B. | 碳原子都共平面 | ||
| C. | 都能与Na2CO3反应 | D. | 都能水解 |
| A. | 澄清透明的溶液中:MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$、K+、Fe3+ | |
| B. | 加入铝粉产生氢气的溶液:Na+、K+、SO42-、Cl- | |
| C. | 使pH试纸变红的溶液中:NH4+、Cu2+、SO42-、Cl- | |
| D. | 0.1mol•L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3- |
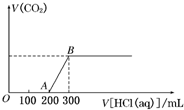 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求:
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求: