题目内容
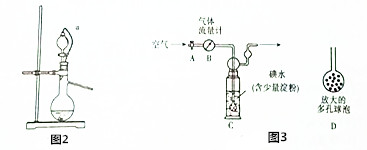
14. 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求:
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求:(1)放出的CO2在标准状况下的体积
(2)溶液X的成分及物质的量之比.
分析 (1)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O→A段消耗的盐酸为A→B消耗的盐酸的二倍,应为NaOH和Na2CO3的混合物,都可与盐酸反应,据此写出反应的离子方程式;AB段碳酸氢根离子与氯化氢反应生成二氧化碳气体;根据AB段消耗氯化氢溶液的体积及氯化氢的浓度计算出生成二氧化碳的物质的量及标况下的体积;
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→B的二倍,反应产物应为NaOH和Na2CO3的混合物,AB段碳酸氢根离子与氢离子反应生成二氧化碳气体,反应的离子反应为:HCO3-+H+=CO2↑+H2O,碳酸钠消耗盐酸的体积为100mL,则氢氧化钠消耗的盐酸体积也是100mL,即Na2CO3与NaOH的物质的量相等,由此分析解答.
解答 解:(1)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→B的二倍,反应产物应为NaOH和Na2CO3的混合物,二者都可与盐酸反应,反应的离子方程式分别为:OH-+H+═H2O、CO32-+H+═HCO3-;
AB段碳酸氢根离子与氢离子反应生成二氧化碳气体,反应的离子反应为:HCO3-+H+=CO2↑+H2O,碳酸钠消耗盐酸的体积为100mL,则氢氧化钠消耗的盐酸体积也是100mL,即Na2CO3与NaOH的物质的量相等,根据钠离子守恒,则碳酸钠的物质的量为:$\frac{1}{3}$×(3mol/L×0.1L)=0.1mol,根据碳原子守恒,反应生成二氧化碳的物质的量为0.1mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L=2240mL,
答:放出的CO2在标准状况下的体积2240mL;
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→B的二倍,反应产物应为NaOH和Na2CO3的混合物,AB段碳酸氢根离子与氢离子反应生成二氧化碳气体,反应的离子反应为:HCO3-+H+=CO2↑+H2O,碳酸钠消耗盐酸的体积为100mL,则氢氧化钠消耗的盐酸体积也是100mL,即Na2CO3与NaOH的物质的量相等,则碳酸钠的物质的量为:$\frac{1}{3}$×(3mol/L×0.1L)=0.1mol,答:成份是NaOH和Na2CO3;物质的量之比为1:1.
点评 本题考查混合物的计算,题目难度中等,注意从图象分析反应可能的情况进行判断和计算,本题关键是根据图象判断溶液溶质的成分,注意在计算过程中守恒思想的应用.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案| A. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
| A. | 从酒精和水的混合物中分离出酒精--蒸馏 | |
| B. | 使浑浊的食盐水变澄清--过滤 | |
| C. | 从碘水中分离出碘--分液 | |
| D. | 把硝酸钾和氯化钾从溶液中分离开来--结晶 |
| A. | 钡可以从氯化钾溶液中置换出钾 | |
| B. | 钡与冷水剧烈反应置换出氢气 | |
| C. | 钡可以从氯化钠溶液中置换出钠 | |
| D. | 在溶液中钡离子可以氧化金属锌,使之成为锌离子 |
| A. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 石油的分馏、煤的气化、海水晒盐、花生中提取花生油等过程都是物理变化 | |
| C. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| D. | 蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
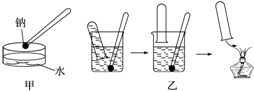 金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示:
金属钠与水的反应是中学化学中的一个重要反应.该反应的演示方法分别如图甲、乙所示: 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.