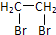题目内容
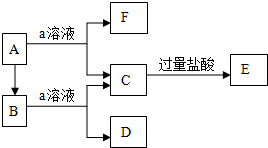
5.某合金只含Al、Fe、Cu,为分析其组成,称取ag样品,设计下列实验流程: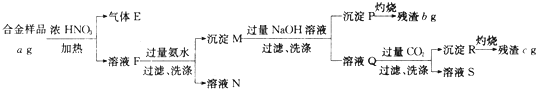
下列相关叙述不正确的是( )
| A. | 气体E呈红棕色,不能直接排放 | |
| B. | 溶液S中所含溶质、沉淀R都可用作药物 | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
分析 a g只含Al、Fe、Cu的合金与足量浓硝酸反应生成红棕色的二氧化氮气体和硝酸铝、硝酸铜和硝酸铁溶液;则E为二氧化氮,F中含有硝酸铝、硝酸铜和硝酸铁,向F溶液中加入过量的氨水,铜离子生成络合物,铁离子和铝离子反应生成M中的氢氧化铝和氢氧化铁沉淀;向M加入过量的氢氧化钠溶液,氢氧化铝溶解得到溶液Q,溶液Q中通入过量二氧化碳后生成沉淀R氢氧化铝,加热氢氧化铝得到残渣氧化铝cg;沉淀P为氢氧化铁,灼烧后得到bg残渣氧化铁,据此进行解答.
解答 解:ag只含Al、Fe、Cu的合金与足量浓硝酸反应生成红棕色的二氧化氮气体和硝酸铝、硝酸铜和硝酸铁溶液;则E为二氧化氮,F中含有硝酸铝、硝酸铜和硝酸铁,向F溶液中加入过量的氨水,铜离子生成络合物,铁离子和铝离子反应生成M中的氢氧化铝和氢氧化铁沉淀;向M加入过量的氢氧化钠溶液,氢氧化铝溶解得到溶液Q,溶液Q中通入过量二氧化碳后生成沉淀R氢氧化铝,加热氢氧化铝得到残渣氧化铝cg;沉淀P为氢氧化铁,灼烧后得到bg残渣氧化铁,
A.根据分析可知,红棕色的气体为二氧化氮,二氧化氮气体有毒,不能直接排放,故A正确;
B.溶液S中的溶质为碳酸氢钠,沉淀R为氢氧化铝,二者都可以治疗胃酸,故B正确;
C.最终得到成cg氧化铝,则原混合物中铝的质量为cg×$\frac{27×2}{102}$=$\frac{9c}{17}$g,氧化铁的质量为bg,则原混合物中Fe的质量为:bg×$\frac{112}{160}$=$\frac{7}{10}$bg,所以原混合物中Cu的质量分数为$\frac{ag-\frac{9c}{17}g-\frac{7b}{10}g}{ag}$×100%=$\frac{170a-9c-7b}{170a}$×100%,故C错误;
D.原混合物中的铝转化成cg氧化铝,则原混合物中铝的质量为:cg×$\frac{27×2}{102}$=$\frac{9c}{17}$g,则合金样品中Al的质量分数为:$\frac{\frac{9c}{17}g}{ag}$×100%=$\frac{9c}{17a}$×100%,故D正确;
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确实验流程中各物质组成为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案| A. | Ba2+、Cl-、Na+、SO42- | B. | Al3+、K+、HCO3-、Cl- | ||
| C. | H+、Fe3+、NO3-、SO42- | D. | H+、Na+、Cl-、CO32-、 |
| 物质 | 分子数 | 质量/g | 物质的量/mol | 摩尔质量/g.mol-1 |
| O2 | 8.0 | |||
| H2SO4 | 3.01×1023 |
| A. | Cu | B. | CuO | C. | Cu(OH)2 | D. | Cu2(OH)2CO3 |


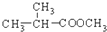 互为同分异构体,则其物质结构简式为HCOOCH(CH3)CH2CH3
互为同分异构体,则其物质结构简式为HCOOCH(CH3)CH2CH3 +CH3CH2CH2OH→
+CH3CH2CH2OH→ +CH3OH
+CH3OH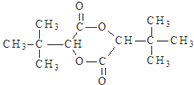 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: