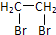题目内容
10.常温下,下列各组离子在指定溶液中不能大量共存的是( )| A. | 澄清透明的溶液中:MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$、K+、Fe3+ | |
| B. | 加入铝粉产生氢气的溶液:Na+、K+、SO42-、Cl- | |
| C. | 使pH试纸变红的溶液中:NH4+、Cu2+、SO42-、Cl- | |
| D. | 0.1mol•L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3- |
分析 A.四种离子之间不反应,为澄清透明溶液;
B.加入铝放出氢气的溶液为酸性或强碱性溶液,四种离子之间不反应,都不与氢离子、氢氧根离子反应;
C.使pH试纸变红的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
D.氢离子与醋酸钠反应生成弱电解质醋酸.
解答 解:A.Fe3+、MnO4-、K+、Fe3+之间不反应,为澄清透明溶液,在溶液中能够大量共存,故A错误;
B.加入铝粉产生氢气的溶液中存在大量氢离子或氢氧根离子,Na+、K+、SO42-、Cl-之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故B错误;
C.使pH试纸变红的溶液为酸性溶液,NH4+、Cu2+、SO42-、Cl-之间不反应,都不与酸性溶液中的氢离子反应,在溶液中能大量共存,故C错误;
D.1CH3COONa、H+之间发生反应,在溶液中能够不能大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的氢离子或氢氧根离子,溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
18.下列判断中一定正确的是( )
| A. | 若 R2-和 M+的电子层结构相同,则原子序数:M>R | |
| B. | 若 X、Y是同主族气态氢化物,且相对分子质量:X>Y,则沸点:X>Y | |
| C. | 若 M、N是同主族非金属元素,且电子层数:M>N,则非金属性:M>N | |
| D. | 若 X、Y属于同周期元素,且原子序数:X>Y,则最高正价:X>Y |
5.下列各装置图对应的叙述正确的是( )
| A. | 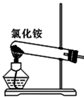 实验室用装置制取氨气 | |
| B. |  装置X若为CCl4,可用于吸收氨气并防止倒吸 | |
| C. |  装置可用于制备氢氧化亚铁并观察其颜色 | |
| D. |  装置是原电池,铁电极为负极,发生氧化反应 |
2.按纯净物、混合物、电解质和非电解质顺序排列的一组物质是( )
| A. | 胆矾、漂白粉、氯化钾、硫酸钡 | B. | 盐酸、空气、硝酸、干冰 | ||
| C. | 冰醋酸、海水、氧化铝、乙醇 | D. | 蛋白质、油脂、烧碱、石灰石 |
19.氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g),△H(298K)=+49.4kJ/mol该条件下反应达平衡状态的依据是( )
| A. | v正(CH3OH)=v正(CO2) | B. | 混合气体的密度不变 | ||
| C. | c(CH3OH)=c(H2O) | D. | 混合气体的总物质的量不变 |
20.下列物质间的转化可以一步实现的是( )
| A. | Cu→Cu(OH)2 | B. | CaCl2→CaO | C. | Fe2O3→Fe | D. | Cu(NO3)2→AgNO3 |


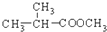 互为同分异构体,则其物质结构简式为HCOOCH(CH3)CH2CH3
互为同分异构体,则其物质结构简式为HCOOCH(CH3)CH2CH3 +CH3CH2CH2OH→
+CH3CH2CH2OH→ +CH3OH
+CH3OH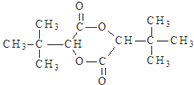 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: