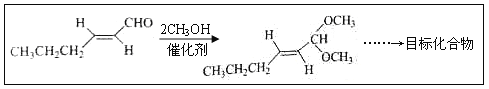
题目内容
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式____。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热化学方程式_____。
(3)已知下列热化学方程式:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol;
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol;
③2H2(g)+O2(g)=2H2O(l ) ΔH3=-571.6kJ/mol,
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_________。
【答案】![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol C4H10(g)+
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol C4H10(g)+![]() O2(g)= 4CO2(g)+5H2O(l) ΔH=-16Q kJ/mol 2C(s)+2H2(g)+O2(g)=CH3COOH(l)ΔH=-488.3 kJ/mol
O2(g)= 4CO2(g)+5H2O(l) ΔH=-16Q kJ/mol 2C(s)+2H2(g)+O2(g)=CH3COOH(l)ΔH=-488.3 kJ/mol
【解析】
(1)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热并书写出中和热的热化学方程式。
(2)根据生成碳酸钙的质量计算丁烷的物质的量,结合燃烧热的概念书写表示丁烷燃烧热化学方程式;
(3)利用盖斯定律计算反应热,并书写热化学方程式。
(1)1mol H2SO4溶液与足量NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-114.6kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol;
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol;
(2)n(CaCO3)=![]() =0.25mol,则根据C元素守恒,可知n(CO2)=0.25mol,即丁烷燃烧生成的二氧化碳为0.25mol,由丁烷燃烧的化学方程式2C4H10+13O2=8CO2+10H2O可知反应的丁烷的物质的量是n(C4H10)=
=0.25mol,则根据C元素守恒,可知n(CO2)=0.25mol,即丁烷燃烧生成的二氧化碳为0.25mol,由丁烷燃烧的化学方程式2C4H10+13O2=8CO2+10H2O可知反应的丁烷的物质的量是n(C4H10)=![]() =
=![]() mol,因为燃烧
mol,因为燃烧![]() mol的丁烷放出的热量为Q,所以燃烧1mol丁烷产生CO2气体和产生液态水放出热量是16QkJ,故丁烷的燃烧热为16QkJ,所以表示丁烷燃烧热化学方程式为C4H10(g)+
mol的丁烷放出的热量为Q,所以燃烧1mol丁烷产生CO2气体和产生液态水放出热量是16QkJ,故丁烷的燃烧热为16QkJ,所以表示丁烷燃烧热化学方程式为C4H10(g)+![]() O2(g)= 4CO2(g)+5H2O(l) ΔH=-16Q kJ/mol;
O2(g)= 4CO2(g)+5H2O(l) ΔH=-16Q kJ/mol;
(3)已知:CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol;
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol;
③2H2(g)+O2(g)=2H2O(l ) ΔH3=-571.6kJ/mol,
利用盖斯定律将②×2+③×2-①可得:
2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
所以热化学方程式为2C(s)+2H2(g)+O2(g)=CH3COOH(l)ΔH=-488.3 kJ/mol。