题目内容
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是_________。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:____________________________________________________________________。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有________________(填化学性质)。
(3)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
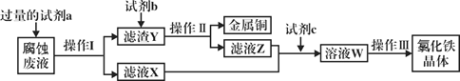
回答下列问题:
①试剂a是___________,操作I用到的玻璃仪器有烧杯、玻璃棒和___________。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________。
③上述流程中操作III包括________________、________________、过滤、洗涤。
【答案】A 研细后用盐酸溶解,滴入KSCN溶液,若溶液变红色,说明已被氧化 还原性 铁(Fe) 漏斗 2Fe2++Cl2=2Fe3++2Cl 蒸发浓缩 冷却结晶
【解析】
(1)当元素处于最高价态时只有氧化性,处于最低价态时只有还原性,处于中间价态时既有氧化性又有还原性;
(2)①根据Fe3+能与KSCN溶液反应导致溶液呈血红色分析解答;②Fe3+具有氧化性,能被还原性物质还原生成Fe2+;
(3)腐蚀液中含有FeCl2、CuCl2,分离难溶性固体和溶液采用过滤方法,所以操作I为过滤;向腐蚀液中加入过量的试剂a,得到滤渣Y和滤液X,加入的a为Fe,滤渣Y为Cu、Fe,滤液X为FeCl2,向滤渣Y中加入试剂b为稀盐酸,然后过滤得到Cu和滤液Z,Z中含有FeCl2和过量稀盐酸,然后加入试剂c,应该加入氯水,将FeCl2氧化为FeCl3,最后将溶液W蒸发浓缩、冷却结晶、过滤得到氯化铁晶体,据此分析解答。
(1)处于最高价态的元素只有氧化性,处于最低价态的元素只有还原性,处于中间价态的元素既有氧化性又有还原性。A.Fe处于最低价态,只有还原性,故A正确;B.FeCl2中Fe元素处于中间价态,既有氧化性又有还原性,故B错误;C.FeCl3中Fe元素处于高价态,具有氧化性,故C错误;D.Fe2O3中Fe元素处于高价态,具有氧化性,故D错误;故选A;
(2)①Fe3+能与KSCN溶液反应生成络合物而导致溶液呈血红色,可以用KSCN溶液检验铁离子,其检验方法为研细后用盐酸溶解,滴入KSCN溶液,若溶液变红色,说明已被氧化,故答案为:研细后用盐酸溶解,滴入KSCN溶液,若溶液变红色,说明已被氧化;
②Fe3+具有氧化性,能被还原性物质还原生成Fe2+,服用维生素C,可使食物中的三价铁离子转化为二价铁离子,说明维生素C能被铁离子氧化,则维生素C具有还原性,故答案为:还原性;
(3)腐蚀液中含有FeCl2、CuCl2,分离难溶性固体和溶液采用过滤方法,所以操作I为过滤;向腐蚀液中加入过量的试剂a,得到滤渣Y和滤液X,加入的a为Fe,滤渣Y为Cu、Fe,滤液X为FeCl2,向滤渣Y中加入的试剂b为稀盐酸,然后过滤得到Cu和滤液Z,Z中含有FeCl2和过量稀盐酸,然后加入试剂c,应该加入氯水,将FeCl2氧化为FeCl3,最后将溶液W蒸发浓缩、冷却结晶、过滤得到氯化铁晶体;
①试剂a是Fe,操作I为过滤,用到的玻璃仪器有烧杯、玻璃棒和漏斗,故答案为:Fe;漏斗;
②滤液X、Z中都有同一种溶质氯化亚铁,它们转化为氯化铁的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
③上述流程中操作III包括蒸发浓缩、冷却结晶、过滤、洗涤,故答案为:蒸发浓缩;冷却结晶。