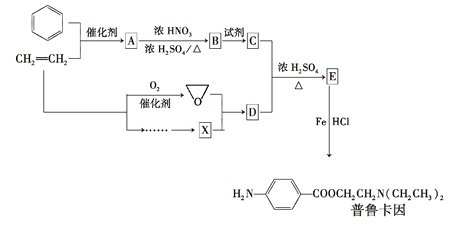
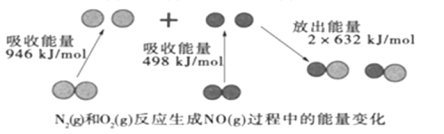
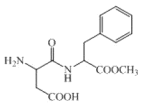
题目内容
【题目】25℃时,体积均为100mL、浓度均为的两种一元碱MOH和ROH的溶液中,分别通入HCl气体,![]() 随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
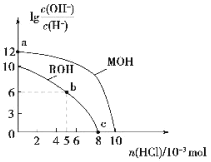
A.MOH是强碱,ROH是弱碱
B.a点由水电离产生的c(H+)和c(OH-)的乘积为1×10-26
C.b点溶液中:c(Cl-)>c(R+)>c(H+)>c(OH-)
D.c点溶液的pH=7,且所含溶质为ROH和RCl
【答案】C
【解析】
分析题给信息,没有通入HCl气体之前,通过![]() 和
和![]() 计算MOH和ROH是否为强碱,MOH的
计算MOH和ROH是否为强碱,MOH的![]() =12,可知0.1mol/LMOH溶液中,c(OH-)=0.1mol/L,则MOH为强碱,同理,0.1mol/LROH溶液中,c(OH-)=0.01mol/L,ROH为弱碱。据此分析。
=12,可知0.1mol/LMOH溶液中,c(OH-)=0.1mol/L,则MOH为强碱,同理,0.1mol/LROH溶液中,c(OH-)=0.01mol/L,ROH为弱碱。据此分析。
A.由分析可知,MOH为强碱,ROH为弱碱,A项正确;
B.0.1mol/LMOH溶液中,c(OH-)=0.1mol/L,OH-来自于碱中,H+来自于水的电离,则c(H+)=10-13mol/L,水电离出的c(H+)与c(OH-)相等,二者乘积为1×10-26,B项正确;
C.b点加入了0.005molHCl,中和了一半的ROH,得到的溶液为ROH和RCl的等物质的量浓度的混合溶液,![]() =6,c(OH-)=10-4,溶液显碱性,则离子浓度大小关系为:c(R+)>c(Cl-)>c(OH-)>c(H+),C项错误;
=6,c(OH-)=10-4,溶液显碱性,则离子浓度大小关系为:c(R+)>c(Cl-)>c(OH-)>c(H+),C项错误;
D.c点时![]() =0,c(H+)=c(OH-),溶液呈中性,pH=7,说明该碱过量,故溶液中溶质为ROH和RCl,D项正确;
=0,c(H+)=c(OH-),溶液呈中性,pH=7,说明该碱过量,故溶液中溶质为ROH和RCl,D项正确;
答案选C。

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
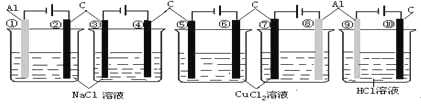
激活思维优加课堂系列答案【题目】如图所示,四支电极均为铂电极,供选择的四组电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH溶液 | AgNO3溶液 | H2SO4溶液 | NaCl溶液 |
乙槽 | CuSO4溶液 | CuCl2溶液 | AgNO3溶液 | AgNO3溶液 |
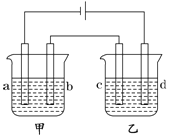
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则:
(1)应选用的电解液是________组。
(2)甲槽的电解方程式为:_____________;乙槽的电解方程式为:_______________。