题目内容
【题目】已知:pBa=-lgc(Ba2+),Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=3.0×10-9。常温下,用 0.1 mol·L-1Na2SO4溶液滴定 20 mL 0.1 mol·L-1BaCl2溶液的曲线如图所示,V0达到滴定终点,下列说法错误的是
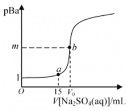
A.图像中,m=5,V0=20
B.若将c(BaCl2)从 0.1 mol· L-1变为 0.2 mol· L-1,m 值将减小
C.a 点溶液中离子浓度大小关系为:c(Cl-)>c(Na+)>c(Ba2+)>c(OH-)
D.向b点溶液中滴加Na2CO3溶液至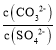 ≥30 时将生成BaCO3
≥30 时将生成BaCO3
【答案】B
【解析】
A. 图像中,m=5,pBa=-lgc(Ba2+)=5,c(Ba2+)=10-5mol· L-1,Ksp(BaSO4)=1.0×10-10,c(SO42-)=10-5mol· L-1,沉淀完全,反应的钡离子和硫酸根离子的量相同,20 mL× 0.1 mol·L-1=V0×0.1 mol·L-1,V0=20mL,故A正确;
B. 若将c(BaCl2)从 0.1 mol· L-1变为 0.2 mol· L-1,m为沉淀完全时,pBa=-lgc(Ba2+),m 值不变,故B错误;
C. a 点溶液中离子浓度大小关系为:c(Cl-)=![]() ,c(Na+)=
,c(Na+)=![]() ,c(Ba2+)=
,c(Ba2+)=![]() ,c(OH-)来源于水电离,c(Cl-)>c(Na+)>c(Ba2+)>c(OH-),故C正确;
,c(OH-)来源于水电离,c(Cl-)>c(Na+)>c(Ba2+)>c(OH-),故C正确;
D. BaSO4+CO32-![]() BaCO3+SO42-,K
BaCO3+SO42-,K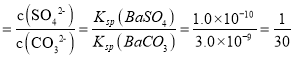 ,向b点溶液中滴加Na2CO3溶液至
,向b点溶液中滴加Na2CO3溶液至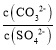 ≥30 时将生成BaCO3,故D正确;
≥30 时将生成BaCO3,故D正确;
故选B。

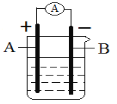
【题目】如图所示,四支电极均为铂电极,供选择的四组电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH溶液 | AgNO3溶液 | H2SO4溶液 | NaCl溶液 |
乙槽 | CuSO4溶液 | CuCl2溶液 | AgNO3溶液 | AgNO3溶液 |
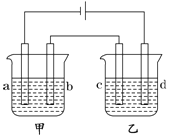
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则:
(1)应选用的电解液是________组。
(2)甲槽的电解方程式为:_____________;乙槽的电解方程式为:_______________。